已知Ka(HA)=1.0×10-7,在 0.1 mol/L HA溶液中,pH值为()A.7.0B.6.0C.8.0D.4.0
题目
已知Ka(HA)=1.0×10-7,在 0.1 mol/L HA溶液中,pH值为()
A.7.0
B.6.0
C.8.0
D.4.0
相似考题
参考答案和解析
更多“已知Ka(HA)=1.0×10-7,在 0.1 mol/L HA溶液中,pH值为()”相关问题
-
第1题:
0.1mol/l三氯乙酸溶液的PH值为()。(已知Ka=0.23)A.0.82
B.1.12
C.0.10
D.1.00
参考答案:B
-
第2题:
浓度为0.1mol/L的某弱酸弱碱盐NH4A溶液pH=7.00,则HA的pKa为( )。
(已知:NH3·H2O的Kb=1.8×10-5)
求计算过程
答案:
NH4A在质子论当作两性物质 [H+]=约=[Ka(NH4+) *Ka(HA)]^1/2 [H+]^2 =Ka(NH4+)* Ka(HA) 而Ka(NH4+)=Kw/Kb(NH3) 因此 [H+]^2 =Kw/ Kb(NH3)* Ka(HA) (10^-7)^2=10^-14 /Kb(NH3)* Ka(HA) 即:Ka(HA)=Kb(NH3)=1.8*10^-5。
-
第3题:
把NaAc晶体加到0.1mol/L HAc溶液中,将会有下列中哪种变化?A.溶液pH值升髙
B.溶液pH值下降
C. Ka增加
D. Ka减小答案:A解析:提示:Ka只与温度有关。HAc溶液中加入NaAc使HAc的电离平衡向左移动,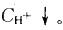
-
第4题:
0.1mol•L-1HA溶液(Ka=1.0×10-5)的pH为()
- A、2.0
- B、2.5
- C、3.0
- D、4.0
正确答案:C -
第5题:
已知某一元弱酸HA的pKa=4.74,则由0.050mol/L的HA和0.050mol/L的NaA组成的缓冲溶液的缓冲指数β为()。
正确答案:0.058 -
第6题:
设弱酸HA的电离度为α,0.1mol/L溶液中的氢离子的浓度是:()
- A、αmol/L
- B、0.1αmol/L
- C、0.01αmol/L
- D、0.001αmol/L
- E、0.0001αmol/L
正确答案:B -
第7题:
某弱酸HA,浓度C=1.0mol/L,Ka=1.0×10-4,则该溶液的pH=2。()
正确答案:正确 -
第8题:
某弱酸HA的Ka=1.0×10-4,则1.0mol·L-1的溶液的pH为()。
- A、4.00
- B、3.00
- C、2.00
- D、6.00
正确答案:C -
第9题:
已知KA(HA)=5×10-4,0.02mol/LHA+0.01mol/LNAA混合溶液的pH值为()
- A、3
- B、4
- C、5
- D、6
正确答案:A -
第10题:
一元弱酸(HA)试样1.250g,加水50mL使其溶解,然后用0.09000mol/LNaOH标准溶液滴至化学计量点,用去NaOH溶液41.20mL。在滴定过程中发现,当加入8.24mLNaOH溶液,使溶液的pH值为4.30。求:HA的Ka
正确答案: PH=pKa+lg(CA-/CHA),CA-=8.24x0.09000/(50.00+8.24)=0.01273mol/L
CHA=(50.00x0.07416-8.24x0.09000)/(50.00+8.24)=0.05093mol/L
于是4.30=pKa+lg(0.01273/0.05093),pKa=4.902,Ka=1.25x10-5 -
第11题:
单选题0.040mol/L碳酸溶液的pH值为(Ka1=4.2×10-7、Ka2=5.6×10-11)()。A3.89
B4.01
C3.87
D6.77
正确答案: A解析: 暂无解析 -
第12题:
单选题某弱酸HA的Ka=1.0×10-4,则1.0mol·L-1的溶液的pH为()。A4.00
B3.00
C2.00
D6.00
正确答案: C解析: 暂无解析 -
第13题:
某弱酸HAc的Ka=1(×)10-5,则其0.1mol/L溶液的PH值为:()?
A.1.0
B.2.0
C.3.0
D.3.5
E.5.0
答案:C
解析:因为是弱酸,所以HAc电离能力很弱,HAc浓度近似等于0.1mol/L,由Ka=【H+】*【Ac-】/【HAc】,【H+】和【Ac-】近似相等,可得【H+】=10-3,PH=-lg(氢离子浓度)所以PH值=3 -
第14题:
当某二元弱酸酸式盐NaHA的浓度为0.lOmol/L时其溶液的pH值为8.31,己知HA的Kal=4.2×10-7,Ka2=5.6×10-11。()此题为判断题(对,错)。
参考答案:正确
-
第15题:
把NaAc晶体加到0.1mol/LHAc溶液中,将会有下列中哪种变化()?
- A、溶液pH值升高
- B、溶液pH值下降
- C、Ka增加
- D、Ka减小
正确答案:A -
第16题:
若弱酸HA的Ka=1.0×10-5,则其0.10mol/L溶液的pH为()。
- A、2.00
- B、3.00
- C、5.00
- D、6.00
正确答案:B -
第17题:
C(HA)=0.050mol•L-1的溶液的pH=5.35,则HA的Ka等于()
- A、2.0×10-11
- B、4.0×10-10
- C、4.5×10-6
- D、8.9×10-5
正确答案:B -
第18题:
0.1mol/l的HCl溶液和0.1mol/l的HAc(Ka=1.8×10-5),溶液等体积混合后,pH值为()。
- A、1.0
- B、2.0
- C、1.3
- D、1.5
正确答案:C -
第19题:
某弱酸HAc的Ka=1(×)10-5,则其0.1mol/L溶液的PH值为:()?
- A、1.0
- B、2.0
- C、3.0
- D、3.5
- E、5.0
正确答案:C -
第20题:
室温下H2CO3饱和溶液的浓度c为0.040mol/L,求该溶液pH值(Ka1=4.2×10-7,Ka2=5.6×10-11)
正确答案: 可应用近似公式求解
=0.41×10-4)(mol/L)
pH=-lg[H+]=3.88 -
第21题:
已知KA(HA)=1.0×10-7,在0.1mol/LHA溶液中,pH值为()
- A、7.0
- B、6.0
- C、8.0
- D、4.0
正确答案:D -
第22题:
某一元弱酸(HA)试样1.250g,加水50.00mL使其溶解,然后用0.09000mol·L-1NaOH标准溶液滴至化学计量点,用去NaOH溶液41.20mL。在滴定过程中发现,当加入8.24mLNaOH溶液,使溶液的pH为4.30,则HA的分子量=();=HA的Kaθ=();计算化学计量点时的pH=();应选用()指示剂。
正确答案:337.1;1.25×10-5;8.76;酚酞 -
第23题:
问答题室温下H2CO3饱和溶液的浓度c为0.040mol/L,求该溶液pH值(Ka1=4.2×10-7,Ka2=5.6×10-11)正确答案: 可应用近似公式求解
=0.41×10-4)(mol/L)
pH=-lg[H+]=3.88解析: 暂无解析 -
第24题:
填空题已知某一元弱酸HA的pKa=4.74,则由0.050mol/L的HA和0.050mol/L的NaA组成的缓冲溶液的缓冲指数β为()。正确答案: 0.058解析: 暂无解析
