(提升题)下列分子或离子中,中心原子的价层电子对几何构型为四面体,而分子(离子)的空间构型为 V 字形的是()A.NH4+B.SO2C.ICl2-D.OF2
题目
(提升题)下列分子或离子中,中心原子的价层电子对几何构型为四面体,而分子(离子)的空间构型为 V 字形的是()
A.NH4+
B.SO2
C.ICl2-
D.OF2
相似考题
更多“(提升题)下列分子或离子中,中心原子的价层电子对几何构型为四面体,而分子(离子)的空间构型为 V 字形的是()”相关问题
-
第1题:
在下列物质的分子中,中心原子采用sp杂化轨道成键,分子空间构型是直线型的是( )。A.
B.
C.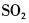
D.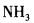 答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。
答案:A解析:见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。 -
第2题:
下列物质中,分子的空间构型为“V”字形的是:A. CO2
B. BF3
C. BaCl2
D. H2S答案:D解析:提示 CO2直线型,H2S中S采取不等性sp3杂化,为“V”字形。 -
第3题:
根据价层电子对互斥理论,下列分子或离子的空间构型是三角锥形的是()
- A、CO3
- B、SO3
- C、BI3
- D、PH3
- E、NO3
正确答案:B,D -
第4题:
下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V形)的是()
- A、NH4+
- B、SO2
- C、H3O+
- D、OF2
正确答案:D -
第5题:
根据价层电子对互斥理论,推测BrO4-的空间构型为(),Br采用()杂化方式;IF3的空间构型为(),I采用()杂化方式。
正确答案:四面体;sp3;T型;sp3d -
第6题:
用价层电子对互斥理论判断,下列分子或离子中,空间构型为平面正方形的是()
- A、CCl4
- B、SiF4
- C、NH4+
- D、ICl4-
正确答案:D -
第7题:
H3O+离子的中心原子O采用()杂化,其中有()个σ键和()个配位键,该中心原子的价层电子对构型为(),离子的几何构型()。
正确答案:不等性SP3;2;1;四面体型;三角锥型 -
第8题:
PH3分子中P原子采取()方式杂化,该中心原子的价层电子对构型为(),分子的几何构型为()。
正确答案:sp3;3s23p3;三角锥型 -
第9题:
根据键的极性和分子的几何构型,判断下列分子哪些是极性分子?哪些是非极性分子? Br2,HF,H2S(V形),CS2(直线形),CHCl2(四面体),CCl4(正四面体)
正确答案: 极性分子:HF、H2S、CHCl3
非极性分子:Br2、CS2、CCl4 -
第10题:
ClF3分子中,中心原子Cl的杂化轨道是(),分子的空间构型是()。
正确答案:SP3d;T形 -
第11题:
具有抗癌作用的顺铂,其分子构型为(),化学组成为(),Ni(CN)42-的构型为(),中心离子的未成对电子对为(),而Ni(CN)42-构型为(),未成对电子对为()
正确答案:正方形;Pt(NH3)2Cl2;正方形;0;四面体;2 -
第12题:
单选题下列说法正确的是( )。A中心原子采取sp3杂化的分子几何构型都是正四面体
BAB4型分子都是非极性分子
C极性分子之间只存在取向力
D所有正面体分子都是非极性分子
正确答案: C解析:
A项:中心原子采取sp3杂化的分子几何构型都是四面体,不一定为正四面体;B项:AB4型分子若为sp3杂化,则为非极性分子;C项,极性分子之间不仅存在取向力,还存在色散力,诱导力等;D项:正面体分子中正负电荷中心重合,不存在永久分子偶极矩,因而为非极性分子。 -
第13题:
下列物质中,分子的空间构型为“V”字形的是:
A. CO2 B. BF3 C. BaCl2 D. H2S答案:D解析:提示:C02直线型,H2S中S采取不等性sp3杂化,为“V”字形。 -
第14题:
PCl3分子,中心原子采取()杂化,其几何构型为(),偶极矩()。
正确答案:sp3;三角锥形;不为0 -
第15题:
根据价层电子对互斥理论XeF2分子中,中心原子的电子构型为(),分子构型为()
正确答案:三角双锥形;直线型 -
第16题:
XeF4的中心原子的价层电子对数为()对,分子空间构型为()
正确答案:6;平面正方形 -
第17题:
对于AB型分子或离子的中心原子价层电子对数的确定1)中心原子价层电子对数=()2)若讨论的对象是离子(负或正)则中心原子的总电子数应()相应的离子电荷数
正确答案:中心原子原有价电子数+配体提供的共用电子数;加上或减去 -
第18题:
按照杂化轨道理论,在CH4分子中,C原子采用sp3杂化轨道与H原子的1s轨道成键,形成一个空间构型为正四面体的分子。H2O分子中O原子用不等性sp3杂化轨道成键,分子的几何构型是()。
正确答案:V字型 -
第19题:
用价层电子对互斥理论判断SO3的分子构型是()
- A、正四面体
- B、V型
- C、三角锥形
- D、平面三角形
正确答案:D -
第20题:
SF4,N2O,XeF2,IF3价层均有5对价电子对,但这些分子的空间构性却不同。这些分子的空间构型分别为变形四面体,直线型,直线型,T型。
正确答案:错误 -
第21题:
已知在AB5、AB4、AB3、AB24种化合物的分子中,中心原子的电子对数都是5,而孤对电子数分为0,1,2,3,按价层电子对互斥理判断它们的几何构型。
正确答案:AB55个电子对分子占据三角双锥的5个顶角,仅一种构型。为三角双锥型。
A.45个电子对分别占据三角双锥5个顶角,其中1顶角为孤电子对,处于三角双锥的三角形的一角,分子构型为变形四面体。
AB35个电子对分别占据三角双锥5个顶角,其中2个孤电子对处于三角双锥的三角形的两角,其构型为T型结构
AB25个电子对分占据三角双锥5顶角,其中3对孤电子对占据三角形的三个顶角,故其构型为直线型。 -
第22题:
下列物质中,分子的空间构型为"V"字形的是()。
- A、CO2
- B、BF3
- C、BeCl2
- D、H2S
正确答案:D -
第23题:
甲醛HCHO分子的中心原子C采用()杂化,空间构型为()。
正确答案:sp2;平面三角形 -
第24题:
单选题下列物质中,分子的空间构型为"V"字形的是()。ACO2
BBF3
CBeCl2
DH2S
正确答案: B解析: 暂无解析
