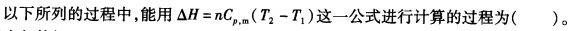3、1 mol理想气体,在373 K时,经下列过程由1013.25 kPa恒温膨胀到101.325 kPa ,计算气体的W、Q、ΔU和ΔH值。 (1) 恒温可逆膨胀; (2) 恒温自由膨胀。
题目
3、1 mol理想气体,在373 K时,经下列过程由1013.25 kPa恒温膨胀到101.325 kPa ,计算气体的W、Q、ΔU和ΔH值。 (1) 恒温可逆膨胀; (2) 恒温自由膨胀。
相似考题
更多“3、1 mol理想气体,在373 K时,经下列过程由1013.25 kPa恒温膨胀到101.325 kPa ,计算气体的W、Q、ΔU和ΔH值。 (1) 恒温可逆膨胀; (2) 恒温自由膨胀。”相关问题
-
第1题:
2mol双原子理想气体,由300kPa、20dm3恒温可逆压缩到15dm3,此过程的W
=()。A.-1726J
B.1726J
C.8.63J
D.1207.6J答案:B解析: -
第2题:
1mol理想气体由同一始态分别经历下列过程:(1)恒温自由膨胀使体积增加1倍;(2)恒温可逆膨胀使体积增加1倍;(3)绝热自由膨胀使体积增加1倍;(4)绝热可逆膨胀使体积增加1倍。下列结论中只有()是正确的。答案:C解析: -
第3题:
A.真实气体恒压可逆膨胀
B.理想气体从T1、P/1变到T2、P2
C.在101.325kPa、100℃时,1mol液体水变为同温、同压的蒸汽
D.在恒容、恒温和W′=0的条件下之化学反应答案:B解析: -
第4题:
下列过程满足△S>0,Q/T环=0的是:()
- A、恒温恒压(273K,101325Pa)下,1mol的冰在空气升华为水蒸气;
- B、氮气与氧气的混合气体可逆绝热膨胀;
- C、理想气体自由膨胀;
- D、绝热条件下化学反应。
正确答案:B -
第5题:
理想气体恒温膨胀做功时ΔU=0,故Q=-W,即所吸之热全部转化为功。此与Kelvin说法有否矛盾?
正确答案:不矛盾。Kelvin的说法是:“不可能从单一热源吸热使之全部转化为功而不引起其它变化”。本例中,虽然热全部转化为功但却引起了系统的体积的变化。 -
第6题:
理想气体从同一始态(p1、V1、T1)出发,分别经恒温可逆膨胀(T)、绝热可逆膨胀(i)到终态体积为V时,体系所做功的绝对值比较:()
- A、WT > Wi
- B、WT < Wi
- C、WT = Wi
- D、无确定关系
正确答案:A -
第7题:
从同一始态膨胀至体积相同的终态时,为什么理想气体的恒温膨胀功总大于绝热可逆膨胀功?
正确答案:两过程中压力下降程度不同,理想气体恒温可逆膨胀过程中从环境吸热因此压力下降较小,而理想气体绝热可逆膨胀过程中无法从环境吸热故压力下降较大,因此理想气体恒温可逆膨胀过程所做的功总是大于绝热可逆膨胀过程所做的功。 -
第8题:
在101.325kPa下,1mol l00℃的水恒温蒸发为100℃的水蒸气。若水蒸气可视为理想气体,那么由于过程等温,所以该过程ΔU = 0。
正确答案:错误 -
第9题:
1 mol单原子理想气体在298K时,在恒定外压为终态压力下从15.00dm3等温膨胀到40.00 dm3,求该过程的Q、W、ΔU和ΔH。
正确答案: ΔU=ΔH=0
P=nRT/V=(1*8.31*298)/(40/1000)=61.94KPa
W=-61.94*(40-15)=-1548.5J
Q=-W=1548.5J -
第10题:
1mol理想气体由500kPa、300K的始态经节流膨胀为原体积的2倍,ΔU=()J,ΔG=()J。
正确答案:0;-1728 -
第11题:
始态为T1=300K,p1=200kPa的某双原子理想气体1mol,经下列不同途径变化到T2=300K,p2=100kPa的末态。求各步骤及途径的Q,△S。(1)恒温可逆膨胀;(2)先恒容冷却至使压力降至100kPa,再恒压加热至T2。(3)先绝热可逆膨胀到使压力降至100kPa,再恒压加热至T2。
正确答案: (1)Q=1.729kJ,△S=5.76J·K-1;
(2)Q1=-3.118kJ,△S1=-14.41J·K-1;Q2=4.365kJ,△S2=-20.17J·K-1;Q=1.247kJ,△S=-5.76J·K-1;
(3)Q1=0,△S1=0;Q=Q2=0.224kJ,△S=△S2=5.76J·K-1; -
第12题:
将1mol、100℃、101.325kPa下的水投入一密封的真空容器中。恒温100℃,恰好全部蒸发为压力为101.325kPa的水蒸气,则此过程的Q();△H();△S();△A();W();Q()。(选择填入:(a)>0;(b)=0;(c)<0;(d)不能确定)
正确答案:a;a;a;b;b;a -
第13题:
以下所列的过程中,()的过程能用△S=△H/T这一公式。A.真实气体绝热可逆膨胀
B.理想气体恒温可逆
C.在101.325kPa、80℃时,1mol液体水变为同温、同压的水蒸气
D.在101.325kPa、0℃时,1mol液体水变为同温、同压的冰答案:D解析: -
第14题:
下列各过程除()过程之外,皆为恒热力学能(又称内能)过程。A.封闭系统绝热、恒容,W′=0的化学反应过程
B.真实气体向绝热的真空器中自由膨胀的过程
C.真实气体节流膨胀过程
D.理想气体恒温可逆膨胀过程答案:C解析: -
第15题:
4mol单原子理想气体从始态750K,150kPa,先恒容冷却使压力降至50kPa,再恒温可逆压缩至100kPa。求整个过程的Q,W,△U,△H及△S.
正确答案: Q=-30.71kJ;W=5.763kJ;△U=-24.94kJ; △H=41.57kJ;△S=-77.86J·K-1 -
第16题:
在温度为298K的恒温浴中,某2mol理想气体发生不可逆膨胀过程。过程中环境对系统做功为3.5kJ,到达终态时体积为始态的10倍。求此过程的Q,W及气体的ΔU,ΔH,ΔS,ΔG,ΔA。
正确答案: 因为在恒温浴中进行,理想气体的ΔU=ΔH=0
Q.-W=-3.5kJ
设计一个始、终态相同的可逆过程,ΔS=QR/T=nRln10=38.3J·K-1
ΔG=ΔA=-TΔS=-11.41kJ -
第17题:
求1molN2(g)在300K恒温下从2dm3可逆膨胀到40dm3时的体积功Wr。假设N2(g)为理想气体。
正确答案: Wr=-nRT1n(V2/V1)=-1×8.3145×300×ln(40÷2)J=-7472J=7.472kJ -
第18题:
理想气体等温可逆膨胀,Q=-W;△G=△A=Wr,ΔU(),ΔH(),ΔS()隔离()。
正确答案:=0;=0;=0 -
第19题:
1mol 300.2K、200kPa的理想气体在恒定外压100kPa下等温膨胀到100kPa。求该过程的△S、△F和△G。
正确答案: △S=5.76J/K
△F=-1730J
△G=-1730J -
第20题:
3mol的单原子理想气体,从初态T1=300K、p1=100kPa反抗恒定的外压50kPa作不可逆膨胀至终态T2=300K、p2=50kPa,对于这一过程的Q=()、W=()、ΔU=()、ΔH=()。
正确答案:3741J;-3741J;0;0 -
第21题:
理想气体向真空膨胀是恒温过程,它的ΔS可通过设计一个在相同的始态和终态下的恒温可逆过程来计算。理想气体向真空膨胀又是绝热过程,那么它的ΔS是否也可通过设计一个在相同的始态和终态下的绝热可逆过程来计算呢?
正确答案:不可以。因为理想气体向真空膨胀是绝热不可逆过程,它与绝热可逆膨胀不可能达到同一终态。这是因为理想气体向真空膨胀时温度不变,而绝热可逆膨胀时对外做功消耗内能从而温度下降。 -
第22题:
3mol双原子理想气体从始态100K,75dm3,先恒温可逆压缩使体积缩小至50dm3,再恒压加热至100dm3。求整个过程的Q,W,△U,△H及△S。
正确答案: Q.-23.21kJ;W=-4.46kJ;△U=18.75kJ;
△H=26.25kJ;△S=50.40J·K-1 -
第23题:
1mol理想气体在T=300K下,从始态100kPa经下列各过程,求Q,△S及△Siso。(1)可逆膨胀到末态压力50kPa;(2)反抗恒定外压50kPa不可逆膨胀至平衡态;(3)向真空自由膨胀至原体积的2倍。
正确答案: (1)Q=1.729kJ,△S=5.763J·K-1,△Siso=0;
(2)Q=1.247kJ,△S=5.763J·K-1,△Siso=1.606J·K-1;
(3)Q=0kJ,△S=5.763J·K-1,△Siso=5.763J·K-1; -
第24题:
已知苯(C6H6)在101.325kPa下于80.1℃沸腾,△vapHm=30.878kJ·mol-1。液体苯的摩尔定压热容Cp,m=142.7J·mol-1·K-1。今将40.53kPa,80.1℃的苯蒸气1mol,先恒温可逆压缩至101.325kPa,并凝结成液态苯,再在恒压下将其冷却至60℃。求整个过程的Q,W,△U,△H及△S。
正确答案: Q=-36.437kJ;W=5.628kJ;△U=-30.809kJ;△H=-33.746kJ;△S=-103.39J·K-1