在某温度下平衡A +B = G + F 的△H<0,升高温度平衡逆向移动的原因是()。A.正反应速率减小,逆反应速率增大B.正反应速率常数减小,逆反应速率常数增大C.正反应和逆反应速率都减小D.正反应速率增加的倍数小于逆反应速率增加的倍数
题目
在某温度下平衡A +B = G + F 的△H<0,升高温度平衡逆向移动的原因是()。
A.正反应速率减小,逆反应速率增大
B.正反应速率常数减小,逆反应速率常数增大
C.正反应和逆反应速率都减小
D.正反应速率增加的倍数小于逆反应速率增加的倍数
相似考题
参考答案和解析
更多“在某温度下平衡A +B = G + F 的△H<0,升高温度平衡逆向移动的原因是()。”相关问题
-
第1题:
某温度下,在密闭容器中进行如下反应2A(g)+B(g)2C(g),开始时p(A)=p(B)=300kPa,p(C)=0kPa,平衡时,p(C)=100kPa,在此温度反应的标准平衡常数K是( )。A. 0.1
B. 0.4
C. 0.001
D. 0.002答案:A解析:由题意可知
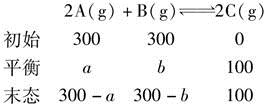
列出等量关系式,2b=100,a=100,解得b=50,得到
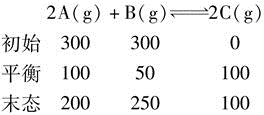
因此
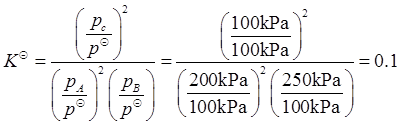
-
第2题:
对于可逆反应,温度对化学平衡的影响说法正确的是()。
- A、升高温度时,化学平衡向正向移动
- B、升高温度时,化学平衡向吸热方向移动,降低温度时,化学平衡向放热方向移动
- C、升高温度时,化学平衡向放热方向移动,降低温度时,化学平衡向吸热方向移动
- D、降低温度时,化学平衡向逆向移动
正确答案:B -
第3题:
可逆反应C(s)+H2O⇄CO(g)+H2(g)△H>0,下列说法正确的是()
- A、达到平衡时,反应物的浓度和生成物的浓度相等
- B、达到平衡时,反应物和生成物的浓度不随时间的变化而变化
- C、由于反应前后分子数相等,所以增加压力对平衡没有影响
- D、升高温度使V正增大,V逆减小,结果平衡向右移动
正确答案:B -
第4题:
影响化学平衡的因素有哪些?()
- A、浓度:当反应达到平衡时,增加反应物浓度则平衡被破坏,平衡向右移动,反应向正方向进行,反之,若增加生成物浓度时,则平衡向左移动,反应向逆方向进行。
- B、压力:对于气体反应,当增高压力时,平衡则向体积增大的方向移动。压力对固体或液体的体积变化影响很小,压力改变时,只考虑反应前后气态物质的分子数有无变化。
- C、温度:在平衡体系中,温度升高,平衡向放热方向移动;反之,温度降低,则平衡向吸热方向移动。
- D、温度:在平衡体系中,温度升高,平衡向吸热方向移动;反之,温度降低,则平衡向放热方向移动。
正确答案:A,B,D -
第5题:
甲醇合成反应中,温度与所反应瞬间平衡浓度的关系是()。
- A、温度升高,平衡浓度下降
- B、温度升高,平衡浓度上升
- C、温度升高,平衡浓度不变
正确答案:A -
第6题:
N2(g)+O2(g)=2NO(g)△H>0下列变化中,不影响平衡状态的是()。
- A、升高温度
- B、加大N2压力
- C、延长反应时间
- D、通入O2
正确答案:C -
第7题:
反应2A(g)+B(g)→C(g)的△rHθm〉0,达到平衡后,升高温度,由于正、逆反应速率均加快,所以上述平衡不发生移动。
正确答案:错误 -
第8题:
在某温度下,反应C2H6(g)=C2H4(g)+H2(g)达到平衡状态,若保持温度和总压力不变,引入不参加反应的水蒸气,乙烯的产率(),若保持温度和体积不变,引入水蒸气使总压增大,乙烯的产率()(增大、减小、不变)。
正确答案:减小;不变 -
第9题:
已知某温度下反应2SO2(g)+O2(g)=2SO3(g) 达平衡状态,平衡常数Kc=10,若使各气体的浓度都是0.2mol·L-1,该反应的平衡状态将()
- A、向右移动
- B、向左移动
- C、不移动
- D、因条件不足,无法判断
正确答案:B -
第10题:
在某温度下,反应1/2N2(g)+3/2H2(g)=NH3(g)的平衡常数K=a,上述反应若写成2NH3(g)=N2(g)+3H2(g),则在相同温度下反应的平衡常数为:()
- A、a/2
- B、2a
- C、a2
- D、1/a2
正确答案:D -
第11题:
反应 C(s,石墨) + CO2(g)2CO(g)当温度升高时,平衡将向()方向移动;当 p(CO2)增大时,平衡将向()方向移动。
正确答案:右;右 -
第12题:
单选题已知在一定温度下,反应C(g)=A(g)+B(g),>0,则下列叙述中正确的是()。A随着反应的不断进行,生成物的含量逐渐增加,反应物的含量逐渐减少,因此平衡常数一定减小
B加入催化剂,反应速度加快,平衡向正反应方向移动
C升高温度,反应速度加快,平衡向正反应方向移动
D增加压力,反应速度加快,平衡向正反应方向移动
正确答案: D解析: 暂无解析 -
第13题:
已知反应2A(g)+B(g)→C(g)的△rHθm〉0,达到平衡后升高温度,则正反应速率的增加大于逆反应速率的增加,所以上述平衡向右移动。
正确答案:正确 -
第14题:
温度对化学平衡的影响与()有关,若正反应为放热反应,则逆反应必为()反应,升高温度将使平衡向()反应方向移动,降低温度将使平衡向()反应方向移动。
正确答案:反应的热效应;吸热;吸热;放热 -
第15题:
CH4+H2O=CO+3H2-Q达到平衡时,升高温度化学平衡向()移动。
- A、正反应方向
- B、逆反应方向
- C、不移动
- D、无法判断
正确答案:A -
第16题:
升高温度,化学平衡向放热反应方向移动;降低温度,化学平衡向吸热反应的方向移动。()
正确答案:错误 -
第17题:
在化学平衡中,温度升高平衡向()方向移动,温度降低平衡向()方向移动。
正确答案:吸热;放热 -
第18题:
PCl5的分解反应:PCl5(g)=PCl3(g)+Cl2(g),2000C达到平衡时有48.5%分解,3000C达到平衡时有97%分解。则下列说法正确的是()
- A、此反应为放热反应
- B、反应是吸热反应
- C、升高温度,平衡逆向移动
- D、压力改变对平衡无影响
正确答案:B -
第19题:
对于化学平衡移动的叙述中,正确的是()
- A、可逆反应达平衡时,增加产物浓度,平衡正向移动
- B、可逆反应达平衡时,增加体系总压力,平衡正向移动
- C、在一定温度下,某可逆反应达平衡时,升高温度,平衡向吸热方向移动
- D、在一定温度下,某可逆反应达平衡时,升高温度,平衡向放热方向移动
正确答案:C -
第20题:
对于可逆反应:C(s)+H2O(g)⇋CO(g)+H2(g),ΔrHmΘ〉0,升高温度使V正增大,V逆减小,故平衡向右移动。
正确答案:错误 -
第21题:
已知在一定温度下,反应C(g)=A(g)+B(g),>0,则下列叙述中正确的是()。
- A、随着反应的不断进行,生成物的含量逐渐增加,反应物的含量逐渐减少,因此平衡常数一定减小
- B、加入催化剂,反应速度加快,平衡向正反应方向移动
- C、升高温度,反应速度加快,平衡向正反应方向移动
- D、增加压力,反应速度加快,平衡向正反应方向移动
正确答案:C -
第22题:
正反应的活化能()于逆反应的活化能,则反应热效应ΔH>0,温度升高,平衡常数() ,平衡向 ()方向移动。
正确答案:大;增大;正反应 -
第23题:
反应2NO(g)+O2(g) →2NO2(g)的ΔrHm<0。若上述反应平衡后,T一定时再增大压力,则平衡向右移动,KӨ不变减少NO2的分压,则平衡向()移动,KӨ不变;在T,p不变下加入惰性气体,则平衡向左移动,KӨ不变;恒压下升高温度,则平衡向()移动,KӨ 变小。
正确答案:右;左 -
第24题:
判断题某化学反应,若ΔH<0,则反应的平衡常数随温度升高而降低。A对
B错
正确答案: 错解析: 暂无解析
