已知在25oC时,电对MnO4- +8H+ + 5e- == Mn2+ + 4H2O的jϴ = 1.5V,若此时c(H+)由1mol dm-3减少到10-4mol dm-3,则该电对的电极电势变化值是 ()A.上升0.38 VB.下降0.38 VC.上升0.047 VD.下降0.047 V
题目
已知在25oC时,电对MnO4- +8H+ + 5e- == Mn2+ + 4H2O的jϴ = 1.5V,若此时c(H+)由1mol dm-3减少到10-4mol dm-3,则该电对的电极电势变化值是 ()
A.上升0.38 V
B.下降0.38 V
C.上升0.047 V
D.下降0.047 V
相似考题
参考答案和解析
更多“已知在25oC时,电对MnO4- +8H+ + 5e- == Mn2+ + 4H2O的jϴ = 1.5V,若此时c(H+)由1mol dm-3减少到10-4mol dm-3,则该电对的电极电势变化值是 ()”相关问题
-
第1题:
电对H+/H2,其电极电势随溶液的pH上升而;电对O2/OH-,其电极电势随溶液的pH上升而。
A、增加,增加
B、降低,降低
C、增加,降低
D、降低,增加
参考答案:B
-
第2题:
下列各电对的电极电势与H+浓度有关的是( )。A、 Zn2+/Zn
B、 Br2/Br-
C、 AgI/Ag
D、 MnO-4/Mn2+答案:D解析:离子的浓度对电极电势有影响,四个选项的电极反应分别为:
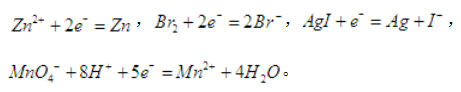
故只有D项当H+浓度变化时,电极电势才会有变化,H+浓度升高,电极电势升高。 -
第3题:
由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,则电池反应的产物为:A. Fe3+和Mn2+
B. MnO4-和Fe3+
C. Mn2+和Fe2+
D. MnO4-和Fe2+答案:A解析:提示:电极电势高的电对作正极,电极电势低的电对作负极。正极发生的电极反应是氧化剂的还原反应,负极发生的是还原剂的氧化反应。即
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+ -
第4题:
由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,
则电池反应的产物为:
A. Fe3+和Mn2+ B. MnO4-和Fe3+ C. Mn2+和Fe2+ D. MnO4-和Fe2+答案:A解析:提示:电极电势高的电对作正极,电极电势低的电对作负极。正极发生的电极反应是氧化剂的还原反应,负极发生的是还原剂的氧化反应。即
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+ -
第5题:
(2012)在铜锌原电池中,将铜电极的c(H+)由1mol/L增加到2mol/L,则铜电极的电极电势:()
- A、变大
- B、变小
- C、无变化
- D、无法确定
正确答案:C -
第6题:
把下列溶液的[H+]换算成pH:(1)某人胃液的[H+]=4.0×10-2mol·dm-3 (2)人体血液的[H+]=4.0×10-8mol·dm-3 (3)食醋的[H+]=1.26×10-3mol·dm-3 (4)番茄汁的[H+]=3.2×10-4mol·dm-3
正确答案: (1)[H+]=4.0×10-2,pH=1.40
(2)[H+]=4.0×10-8,pH=7.40
(3)[H+]=1.26×10-3,pH=2.90
(4)[H+]=3.2×10-4,pH=3.50。 -
第7题:
在某温度时,CaF2饱和溶液的浓度为2×10-4mol·dm-3,则CaF2的溶度积为()
- A、2.6×10-9
- B、4×10-8
- C、3.2×10-11
- D、8×10-12
正确答案:C -
第8题:
向0.1mol·dm-3的氨水溶液中加入NH4Cl固体,使溶液中NH4Cl浓度为0.18mol·dm-3。已知:K(HAc)=1.76×10-5,则溶液的pH值为()
- A、13
- B、5
- C、6
- D、9
正确答案:D -
第9题:
条件电极电势是()
- A、标准电极电势;
- B、任意温度下的电极电势;
- C、任意浓度下的电极电势;
- D、电对的氧化型和还原型的浓度都等于1mol·L-1时的电极电势;
- E、在特定条件下,氧化型和还原型总浓度均为1mol·L-1时,校正了各种外界因素后的实际电极电势。
正确答案:E -
第10题:
任何电对的电极电势的绝对值都不能直接测定,在理论上,某电对的标准电极电势E是将其与()电极组成原电池测定该电池的电动势而得到的。国际上规定上述电极的标准电极电势为()。
正确答案:标准氢;0.0000V -
第11题:
2M →P为二级反应,若M的起始浓度为1mol·dm-3,反应1h后 ,M的浓度减少1/2,则反应2h后,M的浓度是:()
- A、1/4mol·dm-3
- B、1/3mol·dm-3
- C、1/6mol·dm-3
- D、缺少k值无法求
正确答案:B -
第12题:
单选题假设规定标准氢电极的电极电势φθ(H+/H2)=1V,则测得下列原电池:(-)Zn|Zn2+(1mol·dm-3)||H+(1mol·dm-3)|H2(pθ)(Pt)(+)的标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)的数值变化为()A标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各增加1V
B标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)各减少1V
C标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)增加1V
D标准电动势Eθ不变,锌标准电极电势φθ(Zn2+/Zn)减少1V
E标准电动势Eθ和锌标准电极电势φθ(Zn2+/Zn)均不变
正确答案: E解析: 暂无解析 -
第13题:
反应:Zn+2H+(xmol·dm-3)=Zn2+(1mol·dm-3)+H2(100kpa)构成的原电池的电动势为0.46V,φθ(Zn2+/Zn)=- 0.76V,则pH值为。
A、10.2
B、2.5
C、3
D、5.1
参考答案:D
-
第14题:
在铜锌原电池中,将铜电极的c(H+) 由1mol/L增加到2mol/L ,则铜电极的电极电势:A.变大
B.变小
C.无变化
D.无法确定答案:C解析:提示:因为∑MA(F)=0,则对轮应用相对质心的动量矩定理:JAa=0。 -
第15题:
已知E?(Fe3+/Fe2+)=0.77V,E?(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。
A.E?(Fe3+/Fe2+)变小,E?(MnO4-/Mn2+)变大
B.E?(Fe3+/Fe2+)变大,E?(MnO4-/Mn2+)变大
C.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大
D.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)不变答案:C解析:电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大。 -
第16题:
其他条件不变时,能使电对MnO4-/Mn2+的电极电位增大的方法是()
- A、增大pH
- B、降低pH
- C、增大Mn2+浓度
- D、前三个都可以
正确答案:B -
第17题:
对于EA(MnO4-/Mn2+)来说,下列叙述中正确的是()。
- A、Mn2+浓度增大则E值增大
- B、H+浓度的变化对E的影响比Mn2+浓度变化的影响大
- C、溶液稀释,c(MnO4-)/c(Mn2+)值不变,E值也不改变
- D、MnO4-浓度减小,E值增大
正确答案:B -
第18题:
写出电对φθMnO4-/Mn2+,φθCr2O72-/Cr3+φθI2/I-的电极电位大小的排列的顺序。
正确答案:φθMnO4-/Mn2+>φθCr2O72-/Cr3+>φθI2/I- -
第19题:
电极电势值小的电对能被电极电势值大的电对氧化。
正确答案:错误 -
第20题:
已知H2O2分解是一级反应,若浓度由1.0mol·dm-3降至0.6 mol·dm-3需20min,则浓度由0.60mol·dm-3降至0.36mol·dm-3所需的时间是()
- A、超过20分钟
- B、等于20分钟
- C、少于20分钟
- D、无法判断
正确答案:B -
第21题:
已知:Kaθ(HNO2)=7.2×10-4,当HNO2溶液的解离度为20%时,其浓度为()mol·dm-3,c[H+]=()mol·dm-3。
正确答案:1.4×10-2;2.8×10-3 -
第22题:
某化合物与水相作用时,其起始浓度为1mol·dm-3,1小时后为0.5mol·dm-3,2小时后为0.25mol·dm-3。则此反应级数为:()
- A、0
- B、1
- C、2
- D、3
正确答案:B -
第23题:
单选题下列各电对的电极电势与H+浓度有关的是( )。[2016年真题]AZn2+/Zn
BBr2/Br-
CAgI/Ag
DMnO4-/Mn2+
正确答案: B解析:
离子的浓度对电极电势有影响,四个选项的电极反应分别为:Zn2++2e-=Zn;Br2+2e-=2Br-;AgI+e-=Ag+I-;MnO4-+8H++5e-=Mn2++4H2O。故只有D项当H+浓度变化时,电极电势才会有变化,H+浓度升高,电极电势升高。 -
第24题:
单选题已知Eϴ(Fe3+/Fe2+)=0.77V,Eϴ(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。[2019年真题]AEϴ(Fe3+/Fe2+)变小,Eϴ(MnO4-/Mn2+)变大
BEϴ(Fe3+/Fe2+)变大,Eϴ(MnO4-/Mn2+)变大
CEϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)变大
DEϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)不变
正确答案: B解析:
电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,Eϴ(Fe3+/Fe2+)不变,Eϴ(MnO4-/Mn2+)变大。
