对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是() ①锌片上溶解了32.5 g;②锌片增重32.5 g;③铜片上析出了1 g H2;④铜片上析出1 mol H2A.①③B.①④C.②③D.②④
题目
对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是() ①锌片上溶解了32.5 g;②锌片增重32.5 g;③铜片上析出了1 g H2;④铜片上析出1 mol H2
A.①③
B.①④
C.②③
D.②④
相似考题
更多“对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是() ①锌片上溶解了32.5 g;②锌片增重32.5 g;③铜片上析出了1 g H2;④铜片上析出1 mol H2”相关问题
-
第1题:
阅读下列有关材料,按要求完成任务。?
材料一《普通高中化学课程标准(实验)》的内容标准?
举例说明化学能与电能的转化关系及其应用。认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。?
材料二某版本教科书《化学2》(必修)的知识结构体系?
第一章物质结构元素周期律?
第二章化学反应与能量?
第一节化学能与热能?
第二节化学能与电能?
第三节化学反应速率和限度?
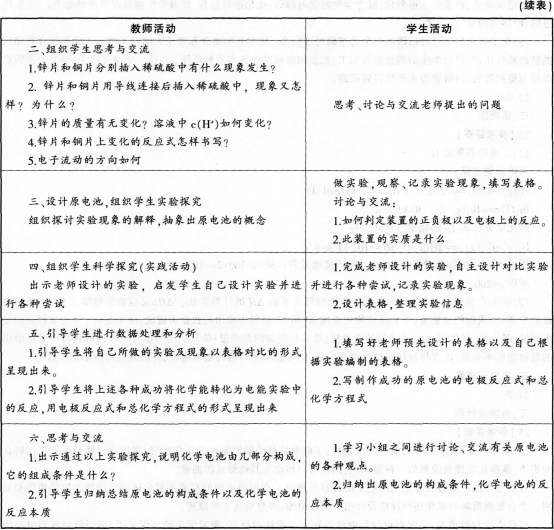
材料三【实验探究】铜片和锌片之间用一条导线连接(导线中间连入一个电流计),平行插入盛有稀硫酸溶液的烧杯中(下图),观察现象。?

【学与问】根据所了解的电学知识,你知道电子是怎样流动的吗?你如何判定装置的正、负极。?
【分析】当把用导线连接的锌片和铜片一同浸入稀硫酸中时,与铜的活动性比较,锌容易失去电子,被氧化成Zn2+进入溶液。电子由锌片通过导线流向铜片。溶液中的H+从铜片获得电子被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。这一变化过程可以表示如下:?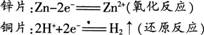
将化学能转变为电能的装置叫作原电池。?
【实践活动】?
目标:根据已具备的氧化还原反应知识和电学知识.利用提供的实验用品,设计一套电池装置。?
用品:镁条、铜片、铁片、导线、金属夹、手电筒用小灯泡(或发光二极管)、果汁(橙汁、苹果汁、柠檬汁等)、电流表、500?mL烧杯。?
设计,并动手试验,边做边改进;也可以与邻座同学进行交流讨论。?
设计及记录:?
试说明化学电池应由哪几部分构成?
【小结】化学电池的反应本质——氧化还原反应。
材料四学校条件和学生发展现状符合国家一般要求。?
针对原电池的构成条件、教学内容。根据上述材料完成下列任务:?
(1)确定三维教学目标。?
(2)确定教学重点和难点。?
(3)设计教学过程。?
(4)设计教学板书。答案:解析:(1)知识与技能:了解原电池的形成条件;了解铜锌稀硫酸原电池的工作原理;理解化学能与电能之间转化的实质;掌握化学能是能量的一种形式,它同样可以转化为其他形式的能量。?
过程与方法:通过反应物之间电子的转移的探究.理解原电池的形成是氧化还原反应的本质的拓展和运用。学会根据简单的氧化还原反应设计出一套原电池,并分析其工作原理。?
情感态度与价值观:通过对设计原电池装置的必要性的研究.激发学生的环保意识,感悟研制新型电池的重要性以及化学电源可能会引起的环境问题,形成较为客观、正确的能源观.提高开发高能清洁燃料的意识。?
(2)教学重点:初步认识原电池概念、原理、组成及应用。?
教学难点:通过对原电池实验的研究。引导学生从电子转移角度理解化学能向电能转化的本质.以及这种转化的综合利用价值.?
(3)教学过程?
(4)教学板书?
第二节化学能与电能?
一、化学能与电能的相互转化?
1.燃煤发电的过程?
2.燃烧的本质——氧化还原反应?
3.原电池?
(1)原电池的定义——将化学能转变为电能的装置叫作原电池。?
(2)原电池的电极?
负极:发生氧化反应,电子流出(流向正极)的一极。?
正极:发生还原反应,电子流入(来自负极)的一极?
(3)组成原电池的条件?
①有两种活动性不同的金属(或一种是非金属导体)作电极。?
②电极材料均插入电解质溶液中(能自发进行氧化还原反应)。?
③两极相连形成闭合电路。?
(4)原电池的原理?
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。?
【小结】?
-
第2题:
案例:
下面是两位中学教师关于“原电池”的教学过程实录。
李老师的教学实录?
【课堂引入】你曾亲身体验趣味实验的神奇吗?你有积极参与趣味实验的兴趣吗?那么请你来亲身体验吧。
【学生】学生用舌尖感受水果电池的电流。
【老师提问】你有什么感觉吗,你的观点是什么呢?
【学生回答】有麻麻的感觉,好像有电。
【课堂投影】1780年意大利解剖学家伽伐尼在做青蛙解剖实验,引导学生做如下实验。
第一步:把一块锌片和铜片分别插入盛有稀硫酸的烧杯里。
第二步:用导线将锌片和铜片连接起来。
第三步:在导线中接入一个灵敏电流计。
【老师】在实验过程中,老师引导学生仔细观察每一个步骤,善于提问、善于分析总结,在实验的过程中学生提出了一系列的问题:
(1)电流表为什么偏向铜?
(2)导线连起来后为什么铜极上有气泡?
(3)电极移动为什么电流表会有变化?……
【课堂投影】利用flash动画向学生展示原电池工作的微观机理。
【得出结论】原电池形成的实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。
【课堂过渡】明白了原电池工作原理,但是原电池形成条件又是怎样呢?
【学生实验】组建四个小组,分别探究原电池形成条件。
【实验结论】四个小组经过认真的实验和分析,通过讨论交流,最终得出原电池形成的条件。
王老师的教学实录?
【视频】播放水果电池充电?
【提示】这个视频你看到了什么?我们知道化学反应一般都伴随着能量的产生,有的转化为热能,有的转化为光能,这个过程中能量是如何进行转换的呢?
【板书】一、原电池的定义:将化学能转化为电能的装置。
【过渡】原电池究竟是如何将化学能转化为电能的呢?今天让我们走上科学的探索之路,首先我们来看一组实验。
【实验】我们一起看以下四组实验现象:第一个实验是将锌片放入硫酸溶液中;第二个实验是将铜片放入硫酸溶液;第三个实验是将锌片和铜片平行插入硫酸溶液中:第四个实验是将锌片和铜片接触放入硫酸溶液中。
【学生】观察实验现象。
【设问】大家就各个实验现象进行解释。
【生1】第一个实验锌片放入硫酸溶液中有气泡产生,是因为锌与硫酸发生置换反应,生成了氢气。
【生2】第二个实验铜片放入硫酸溶液无气泡产生,是因为铜不活泼,不能置换出氢气。
【生3】第三个实验锌片和铜片平行插入硫酸溶液中锌片上有气泡产生,铜片上没有气泡产生,是因为锌与硫酸发生置换反应,生成的氢气,铜不活泼,不能置换出氢气。
【生4】第四个实验是将锌片和铜片接触放入硫酸溶液中,铜片上有气泡产生,锌片上没有气泡产生,应该是铜与硫酸发生置换反应。
【生5】如果可能是铜与硫酸反应,那么实验中有Cu2+,溶液应该变为蓝色,但是实验中溶液没有变成蓝色.所以应该是锌与硫酸发生反应。
【老师】学生对前三个实验的解释很正确,那么对于第四个实验,有学生说是锌与硫酸发生反应。那么为什么在铜片上产生了气泡.而不是在锌片。
【学生讨论】因为锌把电子转移到铜片上。
【提问】电子从何而来?电子是从溶液传递还是锌片与铜片的接触点传递的呢?
【回答】是接触点传递的,如果是溶液传递的,电子应该可以传递到铜的表面的,第三个实验应该铜片表面会产生气泡。
【讲述】如果有电子的移动就应该会有电流,那电流是如何产生的呢?
【过渡】下面我们通过实验来验证:将锌片和铜片用导线连接起来,在导线之间接入灯泡。平行插入稀硫酸溶液中观察实验现象。(注意观察铜片表面的变化)我们一起来分析一下电流的产生原理。
【多媒体展示】Cu-Zn原电池闭合状态下微观粒子运动的动画模拟与实验4相似.并展示Cu片、Zn片上得失电子的反应式。
【讲述】在这个装置中锌片失去电子、失去的电子通过导线传递给铜片,溶液中的H+在铜片的表面得到电子变成氢气,该装置发生了化学反应在外电路产生了电流,电子由Zn片流出,产生了电能?
【过渡】原电池的组成部分有哪些?那么原电池的形成条件是怎样的呢?(改变实验的一个因子)
【引导】让学生认识到实验中三个变量之间的关系:①电极材料:同种电极与不同种电极;②电解质溶液:电解质与非电解质;③通络:闭合回路的形成。暗示以此确定设计实验的探究方向。
【讲解】上面,我们通过实验探究了原电池的工作原理,初步形成原电池的概念,那么,原电池是由哪些部分组成的?也即原电池的构成条件是什么?
【探究一】电极的探究?
【探究二】电路的探究?
【学生活动】学生分组总结汇报实验结果和实验结论,师生共同交流探讨,得出结论?
【板书】略。答案:解析:(1)两位老师在化学课堂上所用的教学方法有讲授法、观察一演示法、讨论法和探究法。
李老师在课堂导入环节运用了实验导入、化学史导入、录像导入等多种导入方法相结合的导入方式,充分激发出学生的学习动机,引起了学生的学习兴趣。
王老师在讲解原电池的组成部分和原电池的形成条件知识时运用了对比实验.改变实验中的一个因子来看实验结果,探究过程清晰明了,使学生能够更深入地理解相关知识。
(2)化学课堂导人的要求有科学性原则、相关性原则、趣味性原则、启发性原则、适度性原则。
(3)化学课堂中实验探究的基本教学思路为:问题—探究—反思。 -
第3题:
已知在25℃,H2(g)+1/2O2(g)=H2O(l)的rHmθ=-285.83kJ·mol-1;该反应的rUmθ=( )。
正确答案:-282.11 kJ·mol-1 -
第4题:
铜片和锌片一同浸在硫酸溶液中,可以看到()。
- A、锌片上有氢气产生
- B、铜片上有氢气产生
- C、两块金属片上都有氢气产生
- D、两块金属片上都没有氢气产生
正确答案:A -
第5题:
当铜片和锌片浸入稀H2SO4中并且用导线联结形成原电池时,产生的现象是()
- A、铜片上有氢气产生
- B、锌片上有氢气产生
- C、铜片溶解
- D、不会有任何变化
正确答案:A -
第6题:
如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在()。
正确答案:阳极 -
第7题:
H2(g)+I2(g)→2HI(g)的反应中,556K时的反应速率常数k1=4.45×10-5 mol-1.L.S-1,700K时k2=6.43×10-2 mol-1.L.S-1。 试求: (1)该反应为几级反应? (2)反应的活化能Ea
正确答案: (1)2
(2)Ea=163.5KJ/mol -
第8题:
已知反应N2(g)+H2(g)=2NH3(g)的标准摩尔焓变为-92.22KJ·mol-1,下列哪一数据为NH3(g)的标准摩尔生成焓()
- A、-46.11KJ·mol-1
- B、-92.22KJ·mol-1
- C、46.11KJ·mol-1
- D、92.22KJ·mol-1
正确答案:A -
第9题:
反应N2(g)+3 H2(g)=2NH3(g),若–dC(N2)/dt =2.0mol.L-1.S-1,则–dC(H2)/dt =()mol.L-1.S-1,–dC(NH3)/dt=()mol.L-1.S-1。
正确答案:6.0;4.0 -
第10题:
已知反应: (1)H2(g)+Br2(1)=2HBr(g)ΔrHθm,1=-72.80kJ·mol-1 (2)N2(g)+3H2(g)=2NH3(g)ΔrHθm,2=-92.22kJ·mol-1 (3)NH3(g)+HBr(g)=NH4Br(s)ΔrHθm,3=-188.32kJ·mol-1 则NH4Br(s)的标准摩尔生成焓ΔfHθm为()kJ·mol-1
- A、-270.83
- B、270.83
- C、-176.20
- D、176.20
正确答案:A -
第11题:
问答题将铜片和锌片插在3%NaCl溶液中,测得铜片和锌片未接通时的电位分别为+0.05V和–0.83V。当用导线通过电流表把铜片和锌片接通,原电池开始工作,电流表指示的稳定电流为0.15mA。已知电路的欧姆电阻为200 。原电池工作后阳极和阴极的电位差Ec–Ea=?正确答案: 根据Ec-Ea=IR
则有:Ec-Ea=IR=0.51mA×200欧=30mV=0.03V
即原电池工作后阳极和阴极的电压差Ec-Ea=0.03V解析: 暂无解析 -
第12题:
填空题如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在()。正确答案: 阳极解析: 暂无解析 -
第13题:
将纯锌片和纯铜片按图3所示方式插入同浓度的稀硫酸中,下列叙述正确的是( )。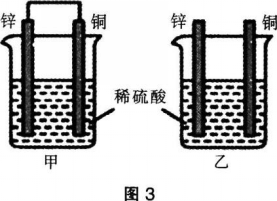 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是阳极.锌片是阴极
C.一段时间后两烧杯中溶液的pH均增大
D.甲产生气泡的速度比乙慢答案:C解析:甲可形成原电池,锌片为负极,铜片为正极,在正极处氢离子得电子产生氢气,有气泡产生。A、B两项错误。甲、乙均消耗稀硫酸,放出氢气,故氢离子浓度均减小,pH增大,C项正确。原电池能加快氧化还原反应的速率,因此甲产生气泡的速度比乙快,D项错误。 -
第14题:
如果要在一块铜片上用电镀的方法镀上一层锌,应该把锌片放在哪里?
正确答案: 应该把锌片放在阳极 -
第15题:
已知H2(g)+ 1/2O2(g)→ H2O(g),ΔrHmθ(298.15K)= -241.818 kJ·mol-1所以说,H2的标准摩尔燃烧焓为ΔcHmθ(298.15K)= -241.818kJ·mol-1
正确答案:正确 -
第16题:
在锌片与铜片相连形成的原电池中,锌片是负极,铜片是正极。
正确答案:正确 -
第17题:
铜片和锌片一同浸在稀硫酸溶液中并用导线连接,这时会发现()。
- A、锌片上有氢气产生
- B、铜片上有氢气产生
- C、两块金属片上都有氢气产生
- D、两块金属片上都没有氢气产生
正确答案:B -
第18题:
在298K,反应H2(g)+1/2O2(g)==H2O(l)的Qp与Qv之差是:()
- A、-3.7kJ.mol-1
- B、3.7kJ.mol-1
- C、1.2kJ.mol-1
- D、-1.2kJ.mol-1
正确答案:A -
第19题:
在298K和101.325kPa时,已知下列反应C(s)+H2O(g)= CO(g)+H2(g) ΔfHθm/kJ.mol-1 -241.8 -110.5 ΔfGθm/kJ.mol-1 -228.6 -137.2 则ΔfSθm为()J.mol-1.K-1
正确答案:133.9 -
第20题:
已知下列热化学方程式 (1)C(g)+ O2(g)= CO2(g) ΔrHθm=–394KJ·mol-1 (2)H2(g)+1/2O2(g)= H2O(l) ΔrHθm= –286KJ·mol-1 (3)C2H6(g)+ 7/2O2(g) = 2CO2(g)+3H2O(l)ΔrHθm= –286KJ·mol-1 由此可得C2H6(g)的ΔfHθm等于 ()
- A、–1360KJ·mol-1
- B、–86KJ·mol-1
- C、+86 KJ·mol-1
- D、无法计算
正确答案:A -
第21题:
298K时,SΘN2=191.50J•K-1•mol-1,SΘH2=130.57J•K-1•mol-1,SΘNH3=192.34J•K-1•mol-1,反应为N2(g)+3H2(g)=2NH3(g),则DrSΘ=()J•K-1•mol-1
- A、-135.73
- B、135.73
- C、-198.53
- D、198.53
正确答案:C -
第22题:
若已知H2O(g)和CO(g)在298K时的标准生成焓ΔHf.2980分别为:-242kJ.mol-1及-111kJ.mol-1,则反应H2O(g)+C(s)→H2(g)+CO(g)的反应热为()kJ。
正确答案:131 -
第23题:
填空题在标准状态下的反应H2(g)+Cl2(g)→2HCl(g),其ΔrHmθ=-184.61kJ•mol-1,由此可知HCl(g)的标准摩尔生成焓变应为()kJ•mol-1正确答案: -92.30kJ.mol-1解析: 暂无解析 -
第24题:
填空题已知在25℃,H2(g)+1/2O2(g)=H2O(l)的rHmθ=-285.83kJ·mol-1;该反应的rUmθ=( )。正确答案: -282.11 kJ·mol-1解析: 暂无解析
