下列晶体溶化时要破坏共价键的是: A. MgO B. CO2 C. SiC D. Cu
题目
下列晶体溶化时要破坏共价键的是:
A. MgO
B. CO2
C. SiC
D. Cu
B. CO2
C. SiC
D. Cu
相似考题
参考答案和解析
答案:C
解析:
提示:MgO为离子晶体,熔化时要破坏离子键;CO2 为分子晶体,熔化时要破坏分子间力;SiC为原子晶体,熔化时要破坏共价键力;Cu为金属晶体,熔化时要破坏金属键力。
更多“下列晶体溶化时要破坏共价键的是: A. MgO B. CO2 C. SiC D. Cu”相关问题
-
第1题:
关于蛋白质变性,下列说法哪项错误?
A.其非共价键破坏 B.其二硫键破坏 C.其四级结构破坏 D.其黏度降低答案:D解析: -
第2题:
下列晶体模型对应的物质熔化时破坏共价键的是()。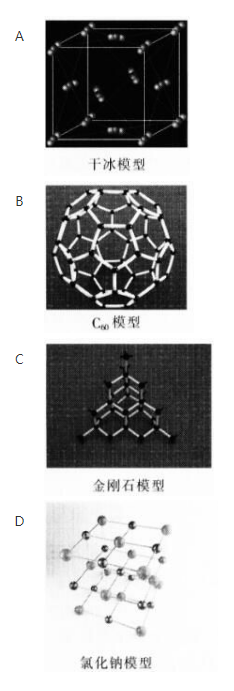 答案:C解析:
答案:C解析:
-
第3题:
下列晶体溶化时要破坏共价键的是:A. MgO
B. CO2
C. SiC
D. Cu答案:C解析:提示:MgO为离子晶体,熔化时要破坏离子键;CO2 为分子晶体,熔化时要破坏分子间力;SiC为原子晶体,熔化时要破坏共价键力;Cu为金属晶体,熔化时要破坏金属键力。 -
第4题:
制备免疫球蛋白片段的方法错误的是A.非共价键解离法
B.温共价键解离法
C.溴化氰裂解法
D.自溶法
E.酶解法答案:D解析:五种免疫球蛋白都具抗原性,皆可提取及纯化,但如分解成片段作为免疫原可制备出分辨力更高的特异性抗血清。制备方法有:非共价键解离法、温共价键解离法、溴化氰裂解法、酶解法。 -
第5题:
下列晶体中,熔化时需破坏共价键的是()
- A、HF
- B、Ag
- C、K2O
- D、SiO2
- E、NaCl
正确答案:D -
第6题:
下列晶体融化时,需要破坏共价键的是()
- A、SiO2
- B、HF
- C、KF
- D、Pb
正确答案:A -
第7题:
下列各种晶体,熔化时需破坏共价键的是()
- A、CO2
- B、SiO2
- C、NaCl
- D、HCl
正确答案:B -
第8题:
下列固态物质的化学式如下,指出它们分属于何种构型的晶体: SiO2:() CO2:() H2O:() Na2O:() Na:() MgO:() Si:()
正确答案:原子晶体;分子晶体;氢键型分子晶体离子晶体;金属晶体;离子晶体;原子晶体 -
第9题:
下列晶体熔化时不需破坏化学键的是( )
- A、晶体硅
- B、食盐
- C、干冰
- D、金属钾
正确答案:C -
第10题:
CO2,SiO2,MgO,Ca的晶体类型分别为(),(),(),()。
正确答案:分子晶体;原子晶体;离子晶体;金属晶体 -
第11题:
在下列各种晶体中熔化时只需克服色散力的是()
- A、SiF4
- B、HF
- C、Ag
- D、CsF
- E、SiC
正确答案:A -
第12题:
单选题下列晶体熔化时不需破坏化学键的是( )A晶体硅
B食盐
C干冰
D金属钾
正确答案: C解析: 暂无解析 -
第13题:
下列叙述正确的是( )。A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中相邻原子间只存在非极性键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高答案:C解析: -
第14题:
下列物质的熔点由高到低排列顺序正确的是:A. HI>HBr>HCl>HF
B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO
D. SiC>CaO>MgO>SiCl4答案:B解析:解:SiC为原子晶体,溶点最高;CaO和MgO为离子晶体,熔点次之;HF、HCl、HBr、HI和SiCl4 为分子晶体,熔点较低。离子晶体中,晶格能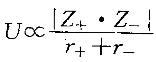 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。 -
第15题:
在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组?A. MgO>CaO>NaF C. CaO>MgO>NaF
B. NaF>CaO>MgO D. NaF>MgO>CaO答案:A解析:提示:影响晶格能的因素主要是离子电荷与离子半径。它们的关系可粗略表示为
在MgO和CaO中,Z+ 、Z- 、r-都相同,不同的是r+ ,由于rMg2+ 2+,所以晶格能: MgO>CaO。在CaO和NaF中,Na与Ca在周期表中处于对角线位置,它们的半径近似相等。虽然ro2-略大于rF- ,但决定晶格能大小的主要因素仍为Z+和Z_。在CaO中Z+与均高于NaF中的Z+与Z- ,所以晶格能CaO>NaF。 -
第16题:
原子晶体的原子间以共价键结合,要破坏这种晶体需要较多的能量,因此原子晶体熔点极高,硬度极大。
正确答案:正确 -
第17题:
加热熔化时需要打开共价键的物质是()
- A、MgCl2
- B、CO2(s)
- C、SiO2
- D、H2O
正确答案:C -
第18题:
熔化下列晶体,需要破坏共价键的是()。
- A、KF
- B、Ag
- C、SiF4
- D、SiC
正确答案:D -
第19题:
判断下列晶体类型,并指出其结合力分别是什么? (1)NaCl(2)SiC(3)CO2(4)Pt
正确答案: (1)NaCl,离子晶体,结合力为离子键;
(2)SiC ,原子晶体,结合力为共价键;
(3)CO2,分子晶体,结合力为分子间力;
(4)Pt,金属晶体,结合力为金属键。 -
第20题:
CO2,SiO2,MgO,Ca的晶体类型分别为(),(),(),();其中熔点最低的物质是()。
正确答案:分子晶体;原子晶体;离子晶体;金属晶体;CO2 -
第21题:
下列晶体熔化时,需要破坏共价键的是()
- A、Si
- B、HF
- C、KF
- D、Cu
正确答案:A -
第22题:
下列晶体熔化时要破坏共价键的是:()
- A、MgO
- B、CO2
- C、SiC
- D、Cu
正确答案:C -
第23题:
CO2,SiO2,MgO,Ca的晶体类别分别是(),熔点最高的是(),熔点最低的是()。
正确答案:分子晶体、原子晶体、离子晶体、金属晶体;SiO2;CO2 -
第24题:
单选题下列晶体熔化时要破坏共价键的是:()AMgO
BCO2
CSiC
DCu
正确答案: A解析: MgO为离子晶体,熔化时要破坏离子键;CO2为分子晶体,熔化时要破坏分子间力;SiC为原子晶体,熔化时要破坏共价键力;Cu为金属晶体,熔化时要破坏金属键力。
