某无色透明溶液,仅由下列离子中的一种或几种组成,向该溶液中通入二氧化碳,有白色沉淀生成,滴加盐酸沉淀消失。若向溶液中滴入少量硝酸银亦会生成白色沉淀,加入硝酸沉淀不溶解,试分析下列离子中Ba2+、Fe3+、Cu2+、Cl-、CO2-3、NO-3,则溶液中一定存在的离子是______;一定不存在的离子是______;可能存在的离子是______。
题目
相似考题
更多“某无色透明溶液,仅由下列离子中的一种或几种组成,向该溶液中通入二氧化碳,有白色沉淀生成,滴加盐酸沉淀消失。若向溶液中滴入少量硝酸银亦会生成白色沉淀,加入硝酸沉淀不溶解,试分析下列离子中Ba2+、Fe3+、Cu2+、Cl-、CO2-3、NO-3,则溶液中一定存在的离子是______;一定不存在的离子是______;可能存在的离子是______。 ”相关问题
-
第1题:
在相同浓度的Cl-、CrO42-离子共存的混合溶液中,逐滴加入硝酸银溶液时,先出现()沉淀A、AgCl
B、Ag2CrO4
C、同时
参考答案:A
-
第2题:
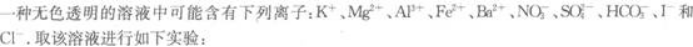
(1)将溶液滴在pH试纸上,试纸显红色.
(2)将少许溶液浓缩后加入铜片和硫酸,有无色气体析出.此气体遇空气则立即变为红棕色.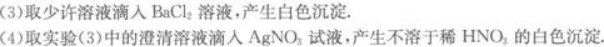
(5)另取少许溶液滴入NaOH溶液,有白色沉淀生成.当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是____________;肯定存在的离子是____________;不能作出判断的离子是____________.写出各步反应的离子方程式____________________________________。答案:解析: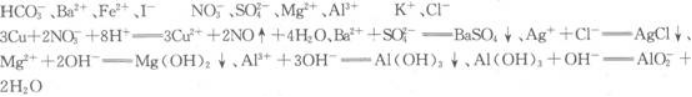
-
第3题:
向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量的氨水(使溶液呈碱性).又有白色沉淀生成:再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀。则原溶液中含有的离子可能是()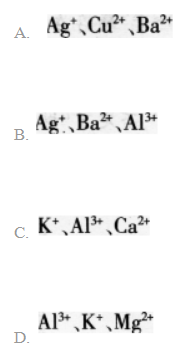 答案:B解析:
答案:B解析:
-
第4题:
在含有氯离子的中性水样中,用硝酸银溶液滴定,溶液中首先析出()沉淀
- A、砖红色
- B、白色
- C、元沉淀
- D、黄色
正确答案:B -
第5题:
沉淀是否完全的标志是被沉淀离子是否符合规定的某种限度,不一定被沉淀离子在溶液在溶液中就不存在
正确答案:正确 -
第6题:
某溶液与Cl-离子作用,生成白色沉淀,加氨水后变黑,则该溶液中可能存在的离子()。
- A、pb2+
- B、Ag+
- C、Hg2+
- D、Hg22+
正确答案:C -
第7题:
向一含的四种离子(主要离子)的混合溶液中滴加AgNO3溶液,至不再有沉淀析出为止.过滤,当用稀硝酸处理沉淀时,砖红色沉淀溶解得橙色溶液,但仍有白色沉淀.滤液呈紫色,用硫酸酸化后,加入Na2SO3,则紫色逐渐消失.作"焰色反应"透过蓝色钴玻璃可以看到紫色火焰.指出上述溶液有何物质?并写有关反应方程式
正确答案: 混合液中含有:KClK2CrO4KMnO4
当加入AgNO3:Ag++Cl-=AgCl↓(白)
2Ag++CrO42-=Ag2CrO4↓(砖红)
加入稀HNO3:AgCl不溶
2Ag2CrO4+2H+=4Ag++Cr2O72-(橙红)+H2O
加入H2SO4酸化,再加入Na2SO3,
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O -
第8题:
硝酸银容量法测定水样中氯化物时,在滴定反应中,Ag+离子可以和Cl-离子作用生成白色AgCl沉淀,也可以和CrO42-离子作用生成红色的Ag2CrO4沉淀。由于(),当AgNO3标准溶液滴加到水样中时,首先生成AgCl的白色沉淀,然后再生成的Ag2CrO4红色沉淀。
正确答案:AgCl的溶解度比Ag2CrO4小 -
第9题:
已知一溶液只有第二组阳离子,将此溶液分成3份,分别得到下述实验结果,试判断哪些离子可能存在? (1) 用水稀释,得到白色沉淀,加HCl溶液则溶解; (2) 加入SnCl2无沉淀发生; (3) 与组试剂作用,生成黄色沉淀,此沉淀一部分溶于Na2S,另一部分不溶,仍为黄色。
正确答案:(1)容易水解的离子如:Bi3+﹑Sb(III)﹑Sn(II)﹑Sn(IV)存在。
(2)可知Hg2+不存在。
(3)生成的硫化物为黄色,则Pb2+﹑Bi3+﹑Cu2+﹑Hg2+不存在。
根据以上判断,可知,有:Cd2+﹑Sn(IV)﹑As(III)﹑As(V)﹑也可有Sb(III)﹑Sb(V)存在。 -
第10题:
将浅绿色晶体A溶于水后加入氢氧化钠和H2O2并微热,得到棕色沉淀B和溶液C。B和C分离后将溶液C加热有碱性气体D放出。B溶于盐酸得黄色溶液E。向E中加KSCN溶液有红色的F生成。向F中滴加SnCl2溶液则红色褪去,F转化为G。向G中滴加赤血盐溶液有蓝色沉淀生成。向A的水溶液中滴加BaCl2溶液有不溶于硝酸的白色沉淀H生成。给出A~H所代表的主要化合物或离子。
正确答案:A.(NH4)2SO4·FeSO4·6H2O
B.Fe(OH)3
C.NH3·H2O
D.NH3
E.FeCl3
F.[Fe(NCS)n]3-n
G.FeCl2
H.BaSO4 -
第11题:
填空题硝酸银容量法测定水样中氯化物时,在滴定反应中,Ag+离子可以和Cl-离子作用生成白色AgCl沉淀,也可以和CrO42-离子作用生成红色的Ag2CrO4沉淀。由于(),当AgNO3标准溶液滴加到水样中时,首先生成AgCl的白色沉淀,然后再生成的Ag2CrO4红色沉淀。正确答案: AgCl的溶解度比Ag2CrO4小解析: 暂无解析 -
第12题:
问答题已知一溶液只有第二组阳离子,将此溶液分成3份,分别得到下述实验结果,试判断哪些离子可能存在? (1) 用水稀释,得到白色沉淀,加HCl溶液则溶解; (2) 加入SnCl2无沉淀发生; (3) 与组试剂作用,生成黄色沉淀,此沉淀一部分溶于Na2S,另一部分不溶,仍为黄色。正确答案: (1)容易水解的离子如:Bi3+﹑Sb(III)﹑Sn(II)﹑Sn(IV)存在。
(2)可知Hg2+不存在。
(3)生成的硫化物为黄色,则Pb2+﹑Bi3+﹑Cu2+﹑Hg2+不存在。
根据以上判断,可知,有:Cd2+﹑Sn(IV)﹑As(III)﹑As(V)﹑也可有Sb(III)﹑Sb(V)存在。解析: 暂无解析 -
第13题:
某溶液中加入过量的盐酸,有白色沉淀生成。滤去沉淀,在滤液中加入过量NH3·H2O,又有白色沉淀生成。再滤去沉淀,并在滤液中加入少量稀硫酸至溶液呈酸性,仍有白色沉淀生成,则原溶液只可能含有的离子组是( )。
A.Ca2+、Al3+、Ag+、
B.Al3+、Ag+、Ba2+ 、
C.Ag+、Mg2+、Ca2+、
D.Ag+、Ba2+ 、Mg2+
正确答案:B
-
第14题:
将下列各组物质放入水中,生成白色沉淀,加入过量稀硝酸,则沉淀消失并有气泡产生,然后滴入AgN03溶液,又生成白色沉淀.则这组物质是( ) 答案:A解析:
答案:A解析: -
第15题:
25℃,在[Cu(NH3)4]SO4水溶液中,滴加BaCl2时有白色沉淀产生,滴加NaOH时无变化,而滴加Na2S时则有黑色沉淀生成,以上实验现象说明该溶液中(Ks为溶度积常数)( )。
A.已无SO42-离子 B.己无游离的NH3 C.已无Cu2+离子
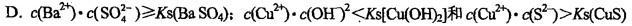 答案:D解析:
答案:D解析: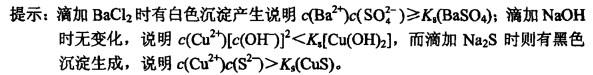
-
第16题:
某溶液与Cl-离子作用,生成白色沉淀,加氨水后变黑,则该溶液中可能存在的离子是()
- A、Pb2+
- B、Ag+
- C、Hg2+
- D、Hg22+
正确答案:C -
第17题:
向一种含有三种阴离子的溶液中,滴加AgNO3至不再生成沉淀,过滤后,当用稀硝酸处理沉淀时,砖红色沉淀消失,得到橙红色溶液,但仍有白色沉淀,而滤液为紫色,用硫酸酸化后,加入亚硝酸钠紫色消失,指出这三种阴离子.写出有关的反应式
正确答案: 三种阴离子为:
Cl-CrO42-或Cr2O72-MnO4-
Cl-+Ag+==AgCl↓(白)
CrO42-+2Ag+==Ag2CrO4↓
(砖红色)
Ag2CrO4+2H+==2Ag++Cr2O72-+H2O
2MnO4-+5SO32-+6H+==2Mn2++5SO42-+3H2O -
第18题:
有一种铝盐是白色晶体,溶于水,溶液混浊,滴加少量盐酸混浊消失,在清液中加入硝酸银溶液生成白色沉淀A,此沉淀不溶于稀硝酸;过滤后在滤液中滴加氢氧化钠溶液,生成白色沉淀,继续滴加过量NaOH,白色沉淀消失形成澄清溶液B,由此推断白色晶体是(),沉淀A是()
正确答案:AlCl3;AgCl -
第19题:
向某溶液中加入过量盐酸,生成白色沉淀,过滤后向滤液中加入过量氨水使溶液呈碱性,又有白色沉淀生成,在过滤后又向溶液中加入Na2CO3溶液,再次生成白色沉淀。原溶液中含有的离子是()()()
正确答案:Ag+;Al3+;Ba2+ -
第20题:
在盛有无色溶液A的试管中,加数滴NaCl溶液,产生白色沉淀,再加入几滴氨水,摇动后沉淀消失,再加入几滴KBr溶液后,又有谈黄色沉淀产生,再加入Na2S2O3溶液后,沉淀又消失,推断A为(),其有关离子反应式(),(),(),()。
正确答案:AgNO3;Ag++Cl-=AgCl;AgCl+2NH3=[Ag(NH3)2]++Cl-;[Ag(NH3)2]++Br-=AgBr2+NH3;AgBr+2S2O32-=[Ag(S2O3)2]3-+Br- -
第21题:
无色晶体A溶于水后加入HCl得白色沉淀B。分离后将B溶于Na2S2O3溶液得无色溶液C。向C中加入盐酸得白色沉淀混合物D和无色气体E。E与碘作用后转化为无色溶液F。向A的水溶液中滴加少量Na2S2O3溶液立即生成白色沉淀G,该沉淀由白变黄、变橙、变棕最后转化为黑色,说明有H生成。请给出A~H所代表的主要化合物或离子。
正确答案:A.AgNO3
B.AgCl
C.[Ag(S2O3)2]3-
D.AgCl+S
E.SO2
F.H2SO4
G.Ag2S2O3
H.Ag2S -
第22题:
填空题有一无色、无气味的澄清液体,其中可能有OH-、SO42-、Cl-、NH4+、Al3+等离子.进行如下试验: (1)用PH试纸检验,pH值约为10: (2)取少量溶液加入硝酸酸化,再加BaCl2溶液,没有出现沉淀; (3)另取少量溶液,加入AgNO3溶液,有白色沉淀,再加硝酸,沉淀不消失; (4)又取少量溶液,稍加热,未发现任何变化. 根据实验现象判断有____离子存在,没有____离子存在.正确答案: OH-、Cl-,SO42-、NH4+、Al3+解析:
溶液pH值为10,呈碱性,则溶液中含有OH-,则不含Al3+;由(2)知,溶液不含SO42-;(3)中白色沉淀含AgOH,可能含有AgCl,加硝酸后沉淀不消失,则白色沉淀中含AgCl,溶液中含有Cl-,由(4)知,溶液不含NH4+,否则会产生刺激性气味的气体. -
第23题:
单选题下列反应中Fe3+离子表现氧化性的是( ).AFeCl3溶液能使KI淀粉试纸变蓝
BFeCl3溶液中加入NaOH溶液产生红褐色沉淀
CFeCl3溶液中加入AgNO3溶液产生白色沉淀
DFeCl3溶液滴入沸水中产生红褐色的胶体
正确答案: B解析:
A项,Fe3+将I-氧化为I2,表现出氧化性,I2遇到淀粉变成蓝色;BCD三项,Fe3+的化合价无升降,没有体现出Fe3+离子的氧化性.
