通过测定原电池电动势的方法来获取AgCl(s)的标准摩尔生成吉布斯函数,,需设计原电池来实现。设计的原电池为 。
题目
通过测定原电池电动势的方法来获取AgCl(s)的标准摩尔生成吉布斯函数,,需设计原电池来实现。设计的原电池为 。
相似考题
更多“通过测定原电池电动势的方法来获取AgCl(s)的标准摩尔生成吉布斯函数,,需设计原电池来实现。设计的原电池为 。”相关问题
-
第1题:
已知原电池反应:Cu(s)+Cl2(g)=Cu2+(aq)+2Cl-(aq)。当增大Cl2(g)压力,原电池的电动势变_______;当增大Cu2+(aq)浓度,原电池的电动势变__________。
A、增加,减小
B、增加,增加
C、减小,增加
D、减小,减小
参考答案:A
-
第2题:
某原电池符号为: ,向AgN03溶液中通入H2S气体,使Ag+生成Ag2S沉淀,这时原电池的电动势将( )。
,向AgN03溶液中通入H2S气体,使Ag+生成Ag2S沉淀,这时原电池的电动势将( )。
A.增大
B.减小
C.不变
D.不能确定答案:B解析:
-
第3题:
在300K、101.325kPa下,有一原电池的电动势E为2V,若在该温度、压力下,原电池向环境可逆输出了2F的电量,则此原电池对环境做了()的电功。A.385.94kJ
B.-385.94kJ
C.-4kJ
D.-192.97kJ答案:B解析: -
第4题:
原电池电动势是原电池两极间的()。
- A、电位差
- B、最大电位差
- C、电流
- D、最大电流
正确答案:B -
第5题:
电位分析法中,分析钾离子活度(pK值),依据的是()
- A、原电池电动势与K+浓度成线形关系
- B、原电池电动势与K+活度成线形关系
- C、原电池电动势与K+浓度对数成线形关系
- D、原电池电动势与K+活度对数成线形关系
正确答案:C -
第6题:
(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第7题:
分别设计可测定下列数据的原电池:水的标准生成焓
正确答案:Pt︱H2(100KPa)︱KOH︱O2(100KPa)︱Pt -
第8题:
对于原电池,极化的结果将使负极电势(),电池电动势()。
正确答案:升高;减小 -
第9题:
单选题(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第10题:
单选题在300K、101.325kPa下,有一原电池的电动势E为2V,若在该温度、压力下,原电池向环境可逆输出了2F的电量,则此原电池对环境做了()的电功。A385.94kJ
B-385.94kJ
C-4kJ
D-192.97kJ
正确答案: D解析: 暂无解析 -
第11题:
单选题向原电池(-)Ag、的负极中加入NaCl,则原电池电动势变化是()。A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第12题:
单选题向原电池(-)Ag,AgCl|Cl-‖Ag+|Ag(+)的负极中加入NaCl,则原电池电动势的变化是( )。[2013年真题]A变大
B变小
C不变
D不能确定
正确答案: D解析:
原电池发生氧化还原反应,负极为:Ag-e-+Cl-=AgCl,正极为:Ag++e-=Ag。根据电极电势的能斯特方程式,有φ=φϴ+0.059lg[1/c(Cl-)]。由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,所以原电池的电动势E=φ正-φ负增大。 -
第13题:
向原电池 的负极中加入NaCl,则原电池电动势的变化是:
A.变大
的负极中加入NaCl,则原电池电动势的变化是:
A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示:负极氧化反应:Ag+Cl-=AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl- = AgCl
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,则电池的电动势增大。 -
第14题:
向原电池(-)Ag,AgCl Cl- Ag+ Ag(+)的负极中加入NaCl,则原电池电动势的变化是:A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示 负极氧化反应:Ag+Cl- =AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl-=AgCl
原电池负极能斯特方程式为: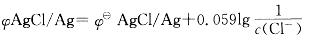
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,
则电池的电动势增大。 -
第15题:
已知φθAg+/Ag=0.80V,φθZn2+/Zn=-0.76V。将两电对组成原电池,该原电池的标准电动势为()
- A、2.36V
- B、0.04V
- C、0.84V
- D、1.56V
正确答案:D -
第16题:
直接电位法测定采用()电极和()电极构成原电池,然后测量原电池电动势,从而求得待测物质含量的。
正确答案:指示;参比 -
第17题:
向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第18题:
向原电池(-)Ag、的负极中加入NaCl,则原电池电动势变化是()。
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第19题:
分别设计可测定下列数据的原电池:水的KW
正确答案:Pt︱H2(101.325KPa)︱KOH︱︱HCl︱︱H2(101.325KPa)︱Pt -
第20题:
分别设计可测定下列数据的原电池:0.1mol.kg-1HBr溶液的r-+
正确答案:Pt︱H2(100KPa)︱HBr(0.1mol.kg-1)︱AgBr(s)︱Ag -
第21题:
判断题标准条件下单质的标准摩尔生成吉布斯函数等于零。A对
B错
正确答案: 对解析: 暂无解析 -
第22题:
单选题原电池电动势是原电池两极间的()。A电位差
B最大电位差
C电流
D最大电流
正确答案: C解析: 暂无解析 -
第23题:
填空题直接电位法测定采用()电极和()电极构成原电池,然后测量原电池电动势,从而求得待测物质含量的。正确答案: 指示,参比解析: 暂无解析 -
第24题:
单选题电位分析法中,分析钾离子活度(pK值),依据的是()A原电池电动势与K+浓度成线形关系
B原电池电动势与K+活度成线形关系
C原电池电动势与K+浓度对数成线形关系
D原电池电动势与K+活度对数成线形关系
正确答案: B解析: 暂无解析
