以浓度为0.1000mol/L的氢氧化钠溶液滴定20mL浓度为0.1000mol/L的盐酸,理论终点后,氢氧化钠过量0.02mL,此时溶液的pH值为()。A、1.00B、3.3C、8.0D、9.7
题目
以浓度为0.1000mol/L的氢氧化钠溶液滴定20mL浓度为0.1000mol/L的盐酸,理论终点后,氢氧化钠过量0.02mL,此时溶液的pH值为()。
A、1.00
B、3.3
C、8.0
D、9.7
相似考题
参考答案和解析
参考答案:D
更多“以浓度为0.1000mol/L的氢氧化钠溶液滴定20mL浓度为0.1000mol/L的盐酸,理论终点后,氢氧化钠过量0.02mL,此时溶液的pH值为()。 ”相关问题
-
第1题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH是( )
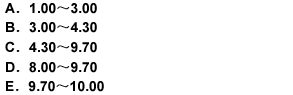 正确答案:C
正确答案:C
-
第2题:
用氢氧化钠滴定液(0.1000mol/L)滴定20ml醋酸溶液(0.1000mol/L),化学计量点的pH值为
A . 8.72 B . 7.00
C . 5.27 D . 4.30 E . 3.50答案:A解析:A
[解析]本题考查酸碱滴定法中化学计量点的计算。
化学计量点时是醋酸钠溶液,溶液pH由Ac伯Kb和Cb决定,由于溶液体积增加一倍,Cb=0.5,[OH-]=(Kb XCb)1/2=(KwXCb/Ka)1/2,经计算,pOH=5.28,pH=8.72。 -
第3题:
甲同学将0.1000 mol/L的盐酸滴入0.1000 mol/L的氢氧化钠溶液中,乙同学将0.1000 mol/L的氢氧化钠溶液滴入0.1000 mol/L的盐酸中,分别绘制滴定曲线,下列说法正确的是()。
A.甲同学的起点pH为1,乙同学的起点pH为13
B.甲同学的起点pH为13,乙同学的起点pH为1
C.甲同学的滴定突跃范围为4.3~9.7,乙同学的滴定突跃范围也为4.3~9.7
D.甲同学的滴定体系中溶液pH逐渐增大,乙同学的滴定体系中溶液pH逐渐减小
[解] AgNO 3 物质的量为0.010×0.020=2.0×10 -4 mol;KI物质的量为0.10×0.005=5.0×10 -4 mol。两者相混,KCl过量,根据吸附的“优先”规律,Cl - 首先吸附在AgCl胶核上,所以胶团的结构如图12-5所示。 -
第4题:
用氢氧化钠滴定液(0.1000mol/L)滴定20ml醋酸溶液(0.1000mol/L),化学计量点的pH值为
A.8.72
B.7
C.5.27
D.4.3
E.3.5
正确答案:A
解析:本题考查酸碱滴定法中化学计量点的计算。化学计量点时是醋酸钠溶液,溶液pH由Ac-的Kb和Cb决定,由于溶液体积增加一倍,Cb=0.5,[OH-]=(Kb×Cb)1/2=(Kw×Cb/Ka)1/2,经计算,pOH=5.28,pH=8.72。 -
第5题:
用氢氧化钠滴定液(0.1000mol/l)滴定20ml醋酸溶液(0. 1000mol/l),化学计量的值为
A.8.72 B. 7.00
C. 5.27 D. 4.30
E.3.50答案:A解析:A
