(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。(1)已知:2NO2(g)=====N2O4(g) ΔH=-57.20 Kj·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。A.减小NO2的浓度 B.降低温度C.增加NO2­的浓度 D.升高温度(2)25℃时,1.00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l)=====
题目
(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g)=====N2O4(g) ΔH=-57.20 Kj·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出
19.14 kJ的热量。则反应2N2H4(l)+N2O4(l)======3N2(g)+4H2O(l)的ΔH=
▲ kJ·mol-1。
(3)17℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2为混合气体(17℃、1.01*105 Pa),理论上至少需消耗Cu多少克?
相似考题
参考答案和解析

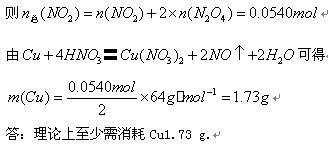
更多“(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。 (1)已知:2 ”相关问题
-
第1题:
2、已知反应N2O4(g) == 2NO2(g),DrH >0,下列能使N2O4(g)的解离度增大的是:
A.体系体积减少1倍
B.降低温度
C.升高温度
D.加入Ar,体系体积不变
A、由于1273K时的转化率大于873K时的转化率,说明温度越高,正向进行程度越大,所以正向反应是吸热反应,故A错误; B、由于K 随温度升高而增大,说明正向反应是吸热反应△H>0,故B正确; C、由于K 随温度升高而增大,说明正向反应是吸热反应△H>0,故C错误; D、由于温度不同,反应进行程度不同,因而转化率不同,反应机理是一样的,故D错误; 故选B. -
第2题:
11、已知N2O4的分解反应为N2O4=2NO2,在25℃时ΔrGmƟ=4.78 kJ mol-1 ,在此温度时,在p(N2O4)=3PƟ,p(NO2)=2PƟ的条件下,反应向()方向进行。
A.左
B.右
C.不变
D.不能确定
左 -
第3题:
2、生石灰消解反应的特点是()。
A.放出大量热且体积大大膨胀
B.吸收大量热且体积大大膨胀
C.放出大量热且体积收缩
D.吸收大量热且体积收缩
A 石灰熟化过程伴随体积膨胀和放热。质纯且锻烧良好的生石灰,在熟化过程中体积将膨胀3~4倍,含杂质且锻烧不良的生石灰体积也有1.5~2倍的膨胀值。 -
第4题:
18、已知N2O4的分解反应为: N2O4(g)→2NO2(g),在25℃时ΔrGmθ = 4.73 kJ·mol-1,在此温度时,在p(N2O4) = 3 pθ, p(NO2) = 2 pθ 的条件下,反应向()方向进行。
A.左
B.右
C.达到平衡
D.无法确定
左 -
第5题:
紫海中发热包主要成分有碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐,生石灰等,其中发热原理是?
A.活性炭与水反应,放出大量的热
B.生石灰与水反应,放出大量的热
C.铁粉与水反应,放出大量的热
D.碳酸钠与水反应,放出大量的热
生石灰与水反应,放出大量的热
