将下列各组物质放入水中,生成白色沉淀,加入过量稀硝酸,则沉淀消失并有气泡产生,然后滴入AgN03溶液,又生成白色沉淀.则这组物质是( )
题目

相似考题
更多“将下列各组物质放入水中,生成白色沉淀,加入过量稀硝酸,则沉淀消失并有气泡产生,然后滴入AgN03溶液,又生成白色沉淀.则这组物质是( )”相关问题
-
第1题:
由两种物质组成的固体混合物,放入水中有白色沉淀生成,加入过量稀HNO3,沉淀消失并有气泡产生,再加入AgNO3溶液,又有白色沉淀生成.该组物质是( )A.Na2CO3和Al(OH)3
B.K3PO4和CaCl2
C.MgCl2和K2CO3
D.K2SO4和BaCl2答案:C解析:
(2)“再加入AgNO3溶液,又有白色沉淀生成.”首先在此之前已加入过量稀HNO3,所以再加AgNO3溶液又有白色沉淀生成,这说明原混合物中应含有Cl-.所以A选项被排除,只有C选项符合要求.
C选项中的MgCl2与K2CO3反应,生成的KCl留在溶液中,所以加入AgNO3发生如下反应:
-
第2题:
某无色透明溶液,仅由下列离子中的一种或几种组成,向该溶液中通入二氧化碳,有白色沉淀生成,滴加盐酸沉淀消失。若向溶液中滴入少量硝酸银亦会生成白色沉淀,加入硝酸沉淀不溶解,试分析下列离子中Ba2+、Fe3+、Cu2+、Cl-、CO2-3、NO-3,则溶液中一定存在的离子是______;一定不存在的离子是______;可能存在的离子是______。答案:解析:Ba2+、Cl-;
Fe3+、Cu2+、CO32-;
NO3-
溶液为无色透明,故一定不存在Fe3+、Cu2+,因为Fe3+为红褐色,Cu2+为蓝色;通入二氧化碳有白色沉淀生成,滴加盐酸后沉淀又消失,故推测一定存在Ba2+;生成的沉淀为碳酸钡白色沉淀,故溶液中一定没有CO32-;向溶液中滴入少量硝酸银,有白色沉淀生成,且加入硝酸沉淀不溶解,可推测出一定存在Cl-,生成白色沉淀为氯化银。 -
第3题:
判断下列各字母所代表的物质:化合物A是一种黑色固体,它不溶于水,稀HAc与NaOH溶液,而易溶于热HCl中,生成一种绿色的溶液B.如溶液B与铜丝一起煮沸,即逐渐变成土黄色溶液C。溶液C若用大量水稀释时会生成白色沉淀D,D可溶于氨溶液中生成无色溶液E。E暴露于空气中则迅速变成蓝色溶液F。往F中加入KCN时,蓝色消失,生成溶液G。往G中加入锌粉,则生成红色沉淀H,H不溶于稀酸和稀碱中,但可溶于热HNO3中生成蓝色的溶液I。往I中慢慢加入NaOH溶液则生成蓝色沉淀J。如将J过滤,取出后强热,又生成原来的化合物A。
正确答案: A.CuO
B.CuCl2
C.H[CuCl2]
D.CuCl
E.[Cu(NH3)2]+
F.[Cu(NH3)4]2+
G.[Cu(CN)4]2-
H.Cu
I.Cu(NO3)2
J.Cu(OH)2 -
第4题:
现有一种含结晶水的淡绿色晶体,将其配成溶液,若加入BaCl2溶液,则产生不溶于酸的白色沉淀;若加入NaOH溶液,则生成白色胶状沉淀并很快变成红综色。再加入盐酸,此红综色沉淀又溶解,滴入硫氰化钾溶液显深红色。问该晶体是什么物质?
正确答案:A:FeSO4·7H2O -
第5题:
在氯化汞溶液中,通入气体A,产生白色沉淀B,将B过滤,在所得滤液中加入氯化钡溶液产生白色沉淀C,其不溶于硝酸,将白色沉淀B转入氯化钠溶液产生黑色沉淀D.将D在空气中加热转化为红色固体物质E.判断A,B,C,D,E各为何物。
正确答案:A.SO2
B.Hg2Cl2
C.BaSO4
D.Hg
E.HgO -
第6题:
有两种物质混合而成的白色固体,其焰色反应应为黄色,取少量于试管中,用水溶解,加入盐酸有气泡生成,逸出的气体有臭鸡蛋味,然后加入过量的盐酸,再滴加BaCl2溶液,有白色沉淀生成,试问混合物的组成为什么?并写出有关反应方程式
正确答案:组成为:Na2S,Na2SO4
Na2S+2HCl=2NaCl+H2S↑
Na2SO4+BaCl2=BaSO4↓+2NaCl -
第7题:
一种白色混合物,加水部分溶解为氯化物溶液A,不溶部分B仍为白色.往A中滴加SnCl2先产生白色沉淀C,而后产生灰黑色沉淀D,往A溶液中加入氨水生成白色沉淀E,而往不溶物B中,加入氨水则B溶解为无色溶液F,再加入硝酸而B重现.A,B,C,D,E,F各为何物。
正确答案:A.HgCl2
B.AgCl
C.Hg2Cl2
D.Hg
E.HgNH2Cl
F.Ag(NH3)2+ -
第8题:
在盛有无色溶液A的试管中,加数滴NaCl溶液,产生白色沉淀,再加入几滴氨水,摇动后沉淀消失,再加入几滴KBr溶液后,又有谈黄色沉淀产生,再加入Na2S2O3溶液后,沉淀又消失,推断A为(),其有关离子反应式(),(),(),()。
正确答案:AgNO3;Ag++Cl-=AgCl;AgCl+2NH3=[Ag(NH3)2]++Cl-;[Ag(NH3)2]++Br-=AgBr2+NH3;AgBr+2S2O32-=[Ag(S2O3)2]3-+Br- -
第9题:
在铝酸盐溶液中加入足量的氢氧化钠固体则()
- A、生成白色沉淀
- B、有气体放出
- C、先生成白色沉淀,而后沉淀消失
- D、生成白色沉淀,并放出气体
正确答案:D -
第10题:
问答题有一块合金,由三种成分组成,其中一种可用来制照明弹.将此合金进行如下处理: (1)将合金放入热的氢氧化钠溶液中,合金部分溶解并产生气体.过滤,得到溶液A,不溶物B; (2)向A中加入适量盐酸,有白色沉淀生成,继续加入盐酸,白色沉淀减少但不完全消失,过滤得到溶液C,不溶物D; (3)向C中加入过量氨水,有白色沉淀E生成,E不溶于氨水,但能溶于烧碱溶液; (4)B可溶于盐酸,生成溶液F,并放出无色气体,向F中加入氨水,生成白色沉淀G,G不溶于氨水,也不溶于烧碱溶液. 根椐以上事实,判断此合金的三种成分是什么?A、B、C、D、E、F、G各是什么物质?正确答案: 合金三种成分中,一种可用来制照明弹,大概推知含镁.合金放入热的氢氧化钠溶液中,合金部分溶解并产生气体,则可推知可能含Al、Si,这两者在浓NaOH溶液中都能放出H2.再综合(1)、(2)、(3)、(4)各种现象,结合中学所学金属的知识知此合的成分为镁、铝、硅,A为NaAlO2和Na2SiO3的混合溶液,B为金属镁,依次可推知C为AlCl3,D为H2SiO3,E为Al(OH)3,F为MgCl2,G为Mg(OH)2.
因此此合金的成分为镁、铝、硅;A、B、C、D、E、F、G分别为NaAlO2和Na2SiO3的混合溶液、Mg、AlCl3、Al(OH)3、H2SiO3、MgCl2、Mg(OH)2.解析: 暂无解析 -
第11题:
单选题将下列某组物质放入水中,生成白色沉淀,加入过量稀HNO3,则沉淀消失并有气泡产生,然后滴入AgNO3溶液,又生成白色沉淀,这组物质是( ).ANa3CO3和KCl
BKNO3和CaCl2
CNa2CO3和Ba(OH)2
DMgCl2和K2CO3
正确答案: D解析:
MgCl2与K2CO3反应生成MgCO3白色沉淀,MgCO3遇硝酸沉淀溶解并生成CO2气体.再滴入AgNO3溶液,则Ag+与原溶液中的Cl-反应生成AgCl白色沉淀. -
第12题:
填空题有一包固体粉末,由下列物质中若干种均匀混合而成:Ba(NO3)2、CaCO3、Na2S、CuSO4、BaCl2,有关实验过程及记录如下:(1)将粉末溶于水,得到蓝色溶液和白色沉淀.过滤后将沉淀洗涤、烘干,称重质量为m克;(2)向滤出的沉淀中加入盐酸,沉淀不溶解;(3)把滤液分成三等份,第一份加稀HNO3和AgNO3溶液,无白色沉淀生成;第二份加入稀H2SO4,无明显现象:第三份加入过量Ba(NO3)2溶液,有白色沉淀生成,把沉淀滤出后洗涤,烘干,称重质量为m克.试判断此白色粉末由____混合而成,它们的物质的量之比为____.正确答案: Ba(NO3)2和CuSO4,1:4解析:
含Cu2+的溶液颜色为蓝色,粉末溶于水后得到蓝色溶液,则粉末中有CuSO4;既然含有CuSO4,则必然不含Na2S,否则两者之间会反应生成黑褐色沉淀CuS,由(2)知,粉末中不含有CaCO3;滤液加稀HNO3和AgNO3溶液,无白色沉淀生成,则溶液中不含有BaCl2;滤液加入稀H2SO4,无明显现象,说明沉淀过滤后,溶液中已经不含有Ba2+;由于粉末溶于水后得白色沉淀,则粉末中含有Ba(NO3)2.滤液加入过量的Ba(NO3)2溶液有白色沉淀生成,说明溶液中仍然含有SO42-,CuSO4是过量的,反应方程式为Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2,刚开始溶于水时产生白色沉淀BaSO4为m克,则各自消耗Ba(NO3)2和CuSO4一份,过滤后剩余的滤液分成三等份,其中一份加入过量Ba(NO3)2溶液,仍然有白色沉淀为m克,则滤液中含CuSO4三份,故Ba(NO3)2和CuSO4的物质的量之比为1:4. -
第13题:
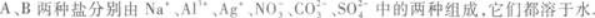
(1)往两种溶液中分别加入盐酸,A溶液不反应,B溶液产生无色无味气体.
(2)往两种溶液中分别加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,B溶液与NaOH不反应.
(3)往两种盐溶液中分别加入BaCl2溶液,都产生白色沉淀.再分别加入稀HNO3,A中沉淀不消失,B中沉淀消失.由此可知,A的化学式为____________,B的化学式为____________.答案:解析:Al2(SO4)3 Na2CO3 【解题指要】 解答此类题目,应熟知各种离子的鉴别反应及反应的特殊现象.另外,分析时应全面照顾,不要漏掉条件.
(1)加入盐酸,B溶液产生无色无味气体.在给出的6种离子中只

即B一定是碳酸盐.
(2)加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,显然这是Al3+的特征反应.其反应方程式为
即A中一定含有Al3+,是铝盐.
(3)向A、B溶液中分别加入BaCl2溶液,都有白色沉淀生成.再分别加入稀HNO3,A中沉淀

-
第14题:
向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量的氨水(使溶液呈碱性).又有白色沉淀生成:再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀。则原溶液中含有的离子可能是()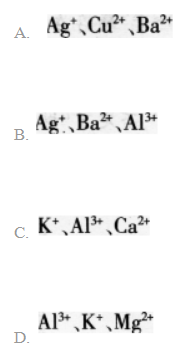 答案:B解析:
答案:B解析:
-
第15题:
某黄色固体,不溶于水,而溶于稀的热盐酸生成橙红色溶液,冷却后析出白色沉淀,加热后白色沉淀又消失,此物质是什么?写出方程式
正确答案: 此固体为PbCrO4(黄)
2PbCrO4+4HCl==2PbCl2+H2Cr2O7+H2O(稀)
PbCl2不溶于冷水溶于热水 -
第16题:
有一种铝盐是白色晶体,溶于水,溶液混浊,滴加少量盐酸混浊消失,在清液中加入硝酸银溶液生成白色沉淀A,此沉淀不溶于稀硝酸;过滤后在滤液中滴加氢氧化钠溶液,生成白色沉淀,继续滴加过量NaOH,白色沉淀消失形成澄清溶液B,由此推断白色晶体是(),沉淀A是()
正确答案:AlCl3;AgCl -
第17题:
有一黄色固体A加热至400℃以上逐渐变为红色.黑色固体最后由无色气体B和液态C生成.将C溶于过量稀热硝酸生成无色溶液D,向D中逐滴入稀氨水产生白色沉淀E.向D中逐滴入SnCl2先产生白色沉淀F,而后又产生灰色沉淀C.判断A,B,C,B,E,F各为何物.用化学式表示
正确答案:A.HgO
B.O2
C.Hg
D.Hg(NO3)2
E.HgNH2Cl
F.Hg2Cl2 -
第18题:
向某溶液中加入过量盐酸,生成白色沉淀,过滤后向滤液中加入过量氨水使溶液呈碱性,又有白色沉淀生成,在过滤后又向溶液中加入Na2CO3溶液,再次生成白色沉淀。原溶液中含有的离子是()()()
正确答案:Ag+;Al3+;Ba2+ -
第19题:
在一种蓝色溶液A中,加入NaOH(80--90℃)产生黑色沉淀B,加入BaCl2溶液产生白色沉淀C,并加酸不溶解.在A溶液中滴加氨水过程中先产生绿色沉淀D,氨水过量时,沉淀消失生成深蓝色溶液E,将E溶液加醋酸酸化后分成两份,分别与黄血盐和KI作用,分别生成红棕色沉淀F和灰紫色沉淀G.判断A.B.C.D.E.F.G各为何物(用化学式表示)
正确答案:A.CuSO4
B.CuO
C.BaSO4
D.Cu2(OH)2SO4
E.Cu(NH3)42+
F.Cu2[Fe(CN)6]
G.CuI+I2 -
第20题:
有一种固体可能含有AgNO3,CuS、ZnCl2、KMnO4、K2SO4。固体加入水中,并用几滴盐酸酸化,有白色沉淀A生成,滤液B是无色的。白色沉淀A能溶于氨水。滤液B分成两份:一份加入少量NaOH时有白色沉淀生成,再加入过量NaOH时,沉淀溶解;另一份加入少量氨水时有白色沉淀生成,再加入过量氨水时,沉淀也溶解。根据上述实验现象,指出哪些物质肯定存在,哪些物质肯定不存在,哪些物质可能存在。
正确答案:肯定存在的:AgNO3、ZnCl2
肯定不存在的:KMnO4、CuS
可能存在的:K2SO4 -
第21题:
单选题将两种溶液混合,有白色沉淀产生,加入稀硝酸,则沉淀消失并有气体生成,加入硫酸,又有白色沉淀生成,这两种溶液是( ).ACuCl2和Na2CO3
BMgCl2和Na2CO3
CCaCl2和Na2CO3
DBaCl2和Na2CO3
正确答案: D解析:
A项,CuCl2和Na2CO3反应生成CuCO3,CuCO3遇水立即双水解为碱式碳酸铜、氢氧化铜的混合物,为蓝色沉淀;B项,Mg2+与硫酸不产生沉淀;C项,生成的CaSO4微溶于水,不是白色沉淀;D项,两种溶液混合,生成BaCO3沉淀,溶解于稀硝酸产生CO2气体,最后加入稀硫酸生成白色沉淀BaSO4.故选D. -
第22题:
单选题将一组物质放入水中,生成白色沉淀,加入过量稀硝酸,沉淀全部溶解并有气体生成然后滴入硝酸银溶液又生成白色沉淀,该组物质是( ).AAgNO3和NaCl
BCaCl2和K2CO3
CNa2CO3和Ba(OH)2
DBaCl2和Na2SO4
正确答案: B解析:
AD两项,根据“生成白色沉淀,加入过量稀硝酸,沉淀全部溶解并有气体生成”可知,该组物质中必有碳酸盐;C项,根据“滴入硝酸银溶液,又生成白色沉淀”可知,该组物质中心有氯化物. -
第23题:
填空题4种正盐A、B、C、D,它们由Na+、Ca2+、Al3+、NH4+、Cl-、SO32-、SO42-和CO32-8种离子组成,鉴别步骤及实验现象如下: (1)取少量A放入试管中,然后加入水,A不溶解. (2)取少量B放入试管中,然后加入水,B全部溶解,其水溶液呈酸性. (3)取少量C放入试管中,然后加入盐酸并加热,反应产生的气体使品红溶液褪色. (4)取少量D放入试管中,然后加入适量稀NaOH溶液,生成白色沉淀;继续加入过量NaOH溶液后沉淀全部溶解.另取少量D放入盛有BaCl2溶液的试管中,生成白色沉淀,加入稀HNO3,沉淀不溶解. 根据以上实验现象,可判断A为____,B为____,C为____,D为____.正确答案: CaCO3,NH4Cl,Na2SO3,Al2(SO4)3解析:
从实验(4)可首先判断出D是Al2(SO4)3.因为其阳离子表现出两性,所以阳离子是Al3+.其阴离子生成钡盐白色沉淀,又不溶于稀HNO3,必为SO42-;
再看实验(1),A化合物不溶于水.因钠盐、铵盐都易溶于水,所以A必是钙盐.因CaCl2溶于水,故只可能是CaSO3,CaSO4或CaCO3.根据实验(3),知道C是亚硫酸盐(因与盐酸反应生成了能漂白品红溶液的SO2;因由(4)排除了CaSO4),从而可以断定A是CaCO3而不是CaSO4或CaSO3.
从实验(2)可知B溶于水,水解后溶液呈酸性,B必为强酸弱碱盐.剩下的离子的组合中只有 NH4Cl符合此条件,故B为NH4Cl.最后,C就是Na2SO3.
