(6分)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题。【实验1】用酚酞试液(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为_________色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为________(结果精确到0.1%)。反应后溶液中的溶质可用_________的方法(填一
题目
(6分)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题。
【实验1】用酚酞试液
(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为_________
色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为________(结果精确到0.1%)。反应后溶液中的溶质可用_________的方法(填一操作名称)使其析出。用酚酞作指示剂可逐滴控制酸、碱溶液反应的量,视觉效果灵敏,操作简便。
相似考题
更多“(6分)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题。【实验1】用酚酞试液(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为_________色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为________(结果精确到0.1%)。反应后溶液中的溶质可用_________的方法(填一”相关问题
-
第1题:
7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g
氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
正确答案:
-
第2题:
下列实验能观察到明显现象的是( )
A.氢氧化钠溶液滴入氯化钡溶液中 B.稀盐酸滴入硫酸钠溶液中
C.硝酸银溶液滴入氯化钠溶液中 D.硫酸钠溶液滴入碳酸钡中
正确答案:C
-
第3题:
(10分)⑴利用如图所示装置可测定空气中氧气的含量。
①实验现象,红色物质逐渐变成 。
②反应的化学方程式为 。
③停止加热冷却至室温,注射器内气体的体积大约减少了 。
④实验结论 。
⑵50g溶质质量分数为7.3%的稀盐酸与50g一定溶质质量分数的氢氧化钠溶液恰好完全反应,求反应后所得溶液溶质质量分数。
正确答案:
14、(10分)⑴
①黑色 ②2 Cu+ O2 ==() 2CuO
③约1/5
④空气中氧气的体积分数大约为1/5
⑵解:设生成的氯化钠的质量为x
HCl+NaOH=NaCl+H2O
36.5 58.5
50g×7.3% x
x=5.85g
所得氯化钠溶液中氯化钠的质量分数为:5.85%
答:略
-
第4题:
U形管中是滴有酚酞试液的蒸馏水,向 左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是 ( )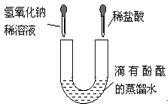 A.开始时左边溶液呈蓝色,右边溶液呈红色
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色答案:C解析: -
第5题:
阅读材料,根据要求完成教学设计任务。
材料一《义务教育化学课程标准(2011年版)》关于“酸和碱的中和反应”的内容标准为:
“认识常见酸碱的主要性质和用途”;活动与探究建议:“设计实验证明氢氧化钠与盐酸能发生化学反应”。
材料二教科书的内容结构体系
第十单元酸和碱
课题l常见的酸和碱
课题2酸和碱的中和反应
材料三教科书“酸和碱的中和反应”所呈现的内容
课题2酸和碱的中和反应
一、中和反应
酸有相似的化学性质,碱也有相似的化学性质。那么,酸与碱能否发生反应园实验10-8如图l0-13所示,在烧杯中加入约5 mL稀氢氧化钠溶液.滴入几滴酚酞溶液。用滴管慢慢滴入稀盐酸,并不断搅拌溶液.至溶液颜色恰好变成无色为止。
在上面的实验中,发生了如下的反应,生成了氯化钠和水: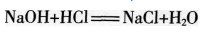
实际上,其他的酸和碱也能发生类似的反应。例如: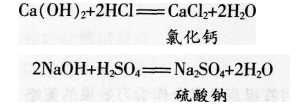
可以发现,上述反应中生成的氯化钠、氯化钙和硫酸钠都由金属离子和酸根离子构成的,我们把这样的化合物叫作盐。
盐在水溶液中能解离出金属离子和酸根离子。酸与碱作用生成盐和水的反应,叫作中和反应。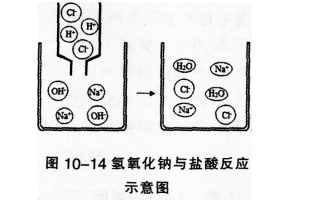
材料四
学校条件和学生发展现状符合一般要求。
要求:
(1)设计“三维”教学目标。
(2)确定教学重点和难点。
(3)设计教学过程(包括新课导入、展示、总结)。
(4)设计教学板书。答案:解析:(1)“三维”教学目标 知识与技能:
①知道酸和碱可以发生中和反应并明确中和反应的概念。
②了解中和反应在实际生活中的应用,可以对实际问题做出简单解释。
过程与方法:
①通过合作探究、讨论交流,培养发现问题、分析问题、解决问题以及动手的能力。
②通过小组讨论和交流,培养收集、处理信息的能力,逐步渗透合作的意识。
情感态度与价值观:
①激发学习化学的兴趣.激发学习化学、用好化学的积极情感。
②体会化学与社会的密切关系,增强对社会的责任感。
(2)教学重、难点
教学重点:
①中和反应及其应用。
②认识溶液酸碱度的表示方法——pH。
教学难点
①中和反应的理解和应用。
⑦酸碱性和酸碱度的区别。
(3)教学过程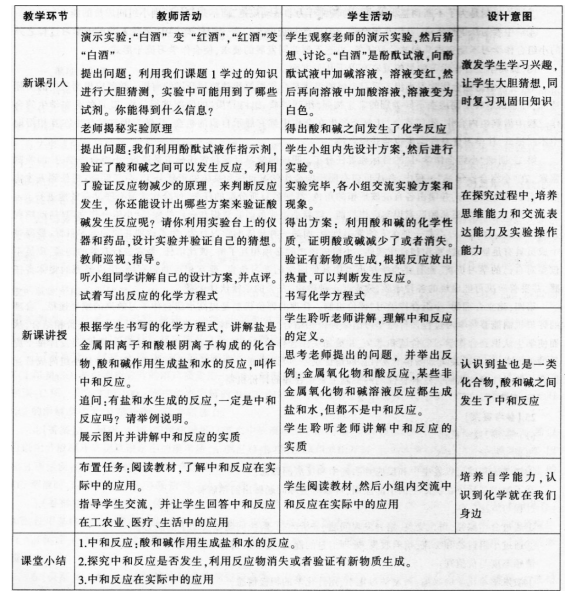
(4)设计教学板书
酸和碱的中和反应
中和反应:酸和碱作用生成盐和水的反应叫作中和反应。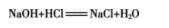
盐:像NaCl、CaCl2、Na2S04这样由金属阳离子(或NHI)和酸根阴离子构成的化合物称为盐 -
第6题:
溶液加水稀释前后,溶液中保持不变的是()。
- A、溶液中溶质质量分数
- B、溶液的质量
- C、溶质的质量
- D、溶剂的质量
正确答案:C -
第7题:
向水与金属钠作用后的溶液中滴入1~2滴酚酞试液,该溶液变红。
正确答案:正确 -
第8题:
向PH值等于11的溶液中滴入1~2滴酚酞试液后,溶液呈红色。
正确答案:正确 -
第9题:
从100g饱和的NaOH溶液中取出20g,将剩余的溶液与原溶液进行比较,没有发生变化的是()。
- A、溶质的质量
- B、溶剂的质量
- C、溶液的质量
- D、溶质的质量分数
正确答案:D -
第10题:
溶液中溶质的质量分数是用溶质质量占溶液质量的百分比来表示的。
正确答案:正确 -
第11题:
多选题在一定温度下,从100gNaOH饱和溶液中倒出20g溶液,对于导出的溶液,其中数值不发生变化的是()。A溶质的质量分数
B溶液的质量
C溶质的质量
DNaOH的溶解度
正确答案: A,B解析: 暂无解析 -
第12题:
填空题10.7g氯化铵与过量的消石灰反应,放出的氨气通入20g溶质质量分数为49%的磷酸溶液中,生成的物质是____.正确答案: (NH4)2HPO4解析:
当NH3和H3PO4的物质的量之比为3:1时,生成正盐(NH4)3PO4;为2:1时,生成一氢盐(NH4)2HPO4;为1:1时,生成二氢盐NH4H2PO4;若不是整数比,小于3:1而大于2:1时,生成(NH4)3PO4和(NH4)2HPO4两种盐;小于2:1而大于1:1时,生成(NH4)2HPO4和NH4H2PO4两种盐.由生成的氨气为0.2mol,磷酸为0.1mol,所以生成磷酸一氢铵. -
第13题:
【实验2】用pH试纸
(2)向一支试管内倒入约2mL氢氧化钠溶液,再逐滴滴入盐酸,边滴边振荡。然后用玻璃棒蘸取反应液沾到pH试纸上,与标准比色卡对照。因无法通过肉眼观察到反应进程,需间隔数滴多次检测溶液的pH,所以每使用玻璃棒蘸取溶液前,必须进行___________的预处理。
正确答案:
洗净并擦干 -
第14题:
向PH值等于11的溶液中滴入1~2滴酚酞试液后,溶液呈红色。()此题为判断题(对,错)。
参考答案:正确
-
第15题:
(8分)纯碱(Na2CO3)是一种重要的盐类物质,在化学工业中用途极广。工业上通常用氨碱法来生产。小红同学为探究纯碱的化学性质进行了猜想,并设计实验进行验证。请你帮助她将下列实验报告填写完整。
猜想 实验操作 实验现象 结论(或化学方程式)
猜想一:Na2CO3溶液显碱性 取少量Na2CO3溶液于试管中,滴入2-3滴酚酞试液,振荡
溶液显碱性
猜想二:能与酸反应 取少量溶液于试管中,然后滴加稀盐酸 有大量气泡产生 化学方程式
猜想三:能与Ca(OH)2反应 向盛有少量Na2CO3溶液于试管中,滴加澄清石灰水 产生白色沉淀 化学方程式
猜想四:能与BaCl2反应
产生白色沉淀 Na2CO3+BaCl2=BaCO3↓+2NaCl
反应的基本类型为
[交流与反思] 若用稀硫酸代替稀盐酸进行实验,是否与猜想二相同? (填“是”或“否”)
正确答案:

-
第16题:
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2 = CaCO3↓+2NaCl)。反应时CaCl2溶液与沉淀的质量关系如图所示。请解决以下问题: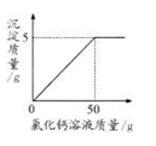
(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数;
(3)恰好完全反应时烧杯中溶液的pH______7(选填“>”、“<”或“=”)答案:解析:(1)解:设样品中碳酸钠的质量为x,加入的氯化钙溶液中的溶质质量为y
Na2C03+CaCl2=CaC03↓ +2NaCl
106 111 100
x Y 5 g
106/100=x/5g
x=5.3 g
该样品中NaOH的质量为l0 g-5.3 g=4.7 g
(2)111/y=100/5g
y= 5.55 g
所加CaCl2溶液的溶质质量分数=5.55g/50g×l00%=11.1%
答:样品中NaOH的质量为4.7 g,所加CaCl2溶液的溶质质量分数为ll.1%
(3) > -
第17题:
向纯碱溶液中滴入几滴酚酞试液,溶液呈粉红色,微热后,溶液的颜色()
正确答案:加深 -
第18题:
在一定温度下,从100gNaOH饱和溶液中倒出20g溶液,对于导出的溶液,其中数值不发生变化的是()。
- A、溶质的质量分数
- B、溶液的质量
- C、溶质的质量
- D、NaOH的溶解度
正确答案:A,D -
第19题:
对溶液进行稀释,稀释前后只是溶液体积和浓度发生了改变,()没变。
- A、溶质的质量分数
- B、溶液中溶剂的量
- C、溶液中溶质的量
- D、溶剂的质量分数
正确答案:C -
第20题:
在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是()
- A、由红色变为蓝色
- B、由蓝色变为红色
- C、由红色变为无色
- D、由无色变成红色
正确答案:C -
第21题:
从一瓶氯化钾溶液中取出20g溶液,蒸干后得到2.8g氯化钾固体。试确定这瓶溶液中溶质的质量分数。
正确答案: 这瓶溶液中溶质的质量分数为:
(2.8/20)×100%=14%
答:这瓶溶液中氯化钾的质量分数为14%。 -
第22题:
在做盐酸中和氢氧化钠溶液的实验时,为什么在氢氧化钠溶液中要滴加几滴酚酞试液?
正确答案:由于盐酸与氢氧化钠溶液反应,没有明显的现象,滴加几滴酚酞试液是为了指示盐酸与氢氧化钠溶液的反应是否恰好完成. -
第23题:
单选题在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是()A由红色变为蓝色
B由蓝色变为红色
C由红色变为无色
D由无色变成红色
正确答案: B解析: 暂无解析
