填空题将54.4g铁和氧化铁的混合粉末投入到适量的稀硫酸中,充分反应后收集到4.48L(标准状况下)氢气并测得溶液中既没有Fe3+也没有固体物质残留,则原混合粉末中铁和氧化铁的质量分别是____g和____g,反应中硫酸消耗掉____mol,反应后得到硫酸亚铁的物质的量是____mol.
题目
相似考题
参考答案和解析
由分析题意可知,最终剩余的铁和三价铁离子恰好完全反应.混合物中的铁的计算分为两部分,一部分是与稀硫酸反应生成氢气,另一部分是和三价铁离子(剩余部分的稀硫酸氧化铁全部转化为三价铁离子)完全反应,生成二价铁离子.
更多“将54.4g铁和氧化铁的混合粉末投入到适量的稀硫酸中,充分反应后收集到4.48L(标准状况下)氢气并测得溶液中既没有Fe”相关问题
-
第1题:
将铁片放入下列溶液中,充分反应后溶液质量减小的是( )
A.三氯化铁
B.稀硫酸
C.硫酸铜
D.浓盐酸
正确答案:C
-
第2题:
把铁和铜的混合物放入稀硝酸中,反应完全后铜有剩余,则此溶液中存在( )A.Fe(NO3)3
B.Fe(NO3)2
C.Fe(NO3)2和Cu(NO3)2
D.Fe(NO3)3和Cu(NO3)2答案:C解析:首先应了解此题涉及的化学反应. 铁和铜在稀硝酸中分别发生下列反应: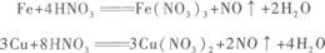
因Cu有剩余,所以Fe(NO3),与Cu还要发生反应: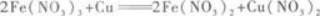
因最后Cu仍有剩余,所以上述反应进行得很完全,即溶液中无Fe(NO3)3存在.溶液含有的
是Fe(NO3)2和Cu(NO3)2. -
第3题:
将8.4 g铁粉跟50 mL盐酸充分混合反应后,有固体剩余,同时收集到1.12 L(标准状况下)H2.原盐酸的物质的量浓度为____________mol/L.答案:解析:2 【解题指要】
(1)铁粉与盐酸混合固体有剩余,即铁粉过量.所以根据反应生成H2的体积,可求得盐酸
中HCl的物质的量.
设50 mL盐酸中HCl的物质的量为xmol,则
所以盐酸的物质的量浓度为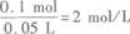

题目已经给出V=0.05 L,所以,只要求得溶质(HCl)的物质的量n代入上式,即可求得c.在
用上式时,应注意V的单位应是“L”,不能用“mL”代入.
(3)Fe与HCl反应的生成物是FeCl2,不是FeCl3.注意不要写错,否则不能得到正确答案. -
第4题:
在溴化亚铁溶液中通入足量Cl2充分反应后,溶液中存在的离子是(??)A.Fe2+、Fe3+
B.Fe2+、Fe3+、Br-、Cl-
C.Br-、Fe3+
D.Cl-、Fe3+答案:D解析: -
第5题:
检查铁盐时,需加入过硫酸铵固体适量的目的在于A.增加颜色深度
B.将低价态铁离子(Fe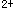 )氧化为高价态铁离子(Fe
)氧化为高价态铁离子(Fe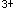 ),同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
),同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
C.将高价态铁离子(Fe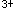 )还原为低价态铁离子(Fe
)还原为低价态铁离子(Fe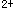 )
)
D.消除干扰
E.加速Fe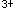 和SCN的反应速度答案:B解析:
和SCN的反应速度答案:B解析: -
第6题:
将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是()
- A、标准状况下,反应过程中得到6.72L的气体
- B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
- C、最终得到的溶液中c(Na+)=1.5mol·L-1
- D、最终得到7.8g的沉淀
正确答案:D -
第7题:
以下实验中能够获得成功的是()
- A、将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl)
- B、将乙醇迅速加热至170℃制乙烯
- C、将还原铁粉、液溴和苯混合制溴苯
- D、检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验
正确答案:C -
第8题:
设NA为阿伏加德罗常数,下列说法正确的是()。
- A、标准状况下,5.6L四氯化碳含有的分子数为0.25NA
- B、标准状况下,14g氮气含有的核外电子数为5NA
- C、标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
- D、标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
正确答案:C -
第9题:
标准状况下,铁与盐酸发生反应产生44.8升氢气,如果盐酸过量,则参加反应的铁为()g。
- A、28
- B、56
- C、112
- D、224
正确答案:C -
第10题:
将铁片放入下列溶液中,充分反应后溶液质量减小的是()。
- A、三氯化铁;
- B、稀硫酸;
- C、硫酸铜;
- D、浓盐酸。
正确答案:C -
第11题:
单选题将7.8gNaO和2.7gAl同时放入一定量的水中,充分反应后得到100mL溶液,再向该溶液中缓慢通入HCl气体3.36L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是()。A反应过程中得到3.36L(标准状况)的气体
B反应结束得到3.9g的沉淀
C反应结束得到的溶液中c(Na+)=c(Cl-)+c(OH-)
D反应结束得到的溶液中c(NaCl)=1.0mol·L-1
正确答案: D解析: 暂无解析 -
第12题:
问答题A、B两种气态烃,标准状况下A的密度为1.25g/L,将总质量为4.4g的A、B混合气体4.48L(标准状况下)通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了2.8g.试求A、B是什么气体?正确答案: A:乙烯;B:甲烷解析:
由于标准状况下烃A的密度为1.25g/L,可知A的相对分子质量M=1.25g/L×22.4L=28g/mol,所以A为乙烯;混合气体体积4.48L,即0.2mol,通入足量的溴的四氯化碳溶液中,乙烯被吸收,因为溴的四氯化碳溶液的质量增加了2.8g,可知原气体中含有0.1mol乙烯,另含有0.1mol B气体,质量为1.6g,即B的相对分子质量为16g/mol,即B为甲烷. -
第13题:
往50 mL稀硫酸和稀盐酸的混合溶液中加入2.137 5 g氢氧化钡粉末,充分反应后进行过滤,滤液的pH=13,其沉淀干燥后质量为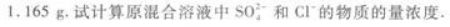 答案:解析:
答案:解析:

(2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4).
(3)因滤液的pH=13,可知Ba(OH)2与H2SO4、HCl反应后,仍有剩余.即加入的Ba(OH)2分为三部分:①与H2SO4反应,②与HCl反应,③剩余.根据BaSO4的物质的量可求出H2SO4消
耗的Ba(OH)2,根据剩余溶液的pH=13可求得剩余的Ba(OH)2.所以用Ba(OH)2的总量,减去
H2SO4消耗的量,再减去剩余的量,最后可得与HCl反应的Ba(OH)2的物质的量,并进一步由Ba(OH)2的物质的量求得HCl的物质的量. -
第14题:
有两种金属的混合粉末15 g,加入足量的盐酸,充分反应后,在标准状况下得到11.2 LH2,则下列各组金属中肯定不能构成上述混合物的是( )A.Mg和Al
B.Mg和Ag
C.Mg和Zn
D.Al和Fe答案:A解析:【解题指要】 (1)Mg、Fe、Zn与盐酸反应均呈+2价,只有Al与盐酸反应时呈+3价,但Al与盐酸反应生成1 mol H2时,需Al的质量为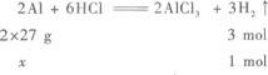

(2)设金属混合物的平均相对原子质量为y(金属均按2价计算),则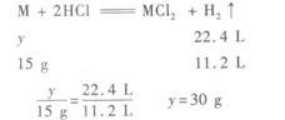
即混合物的平均相对原子质量为30.
(3)由两种金属组成的混合物且其平均相对原子质量为30,则其中必有一种金属的相对原子质量大于30,另一种金属的相对原子质量小于30.C选项,Mg为24,Zn为65.D选项,Al看做+2价时,其相对原子质量为18;Fe为56.所以C、D选项均可.A选项,Mg为24,Al为18(+2价时),都小于30,所以A选项是不可能的.B选项,虽然Ag不与盐酸反应,但因Mg可与盐酸反应放出H2,且Mg的相对原子质量小于30,所以Ag与Mg组成的混合物也符合要求. -
第15题:
一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量.答案:解析:题目中涉及的化学反应如下: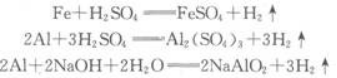

答:原混合物中铝的质量为5.4g,铁的质量为5.6g. -
第16题:
将一定质量的铁粉和氧化铜粉末投入到一定质量的稀硫酸中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法: ①滤液M中一定含有硫酸铁,可能含有硫酸和硫酸铜;
②在滤液M中放入一块刚打磨过的锌片,一定有置换反应发生;
③向滤渣N中滴加稀硫酸.可能有气泡产生;
④当滤液M中含有硫酸铜时,滤渣N中一定没有氧化铜
其中一定正确的说法是( )A.①②
B.②③
C.③④
D.①④答案:B解析:硫酸会与铁反应生成硫酸亚铁和氢气,氧化铜和硫酸反应会生成硫酸铜和水,硫酸铜和铁反应会生成硫酸亚铁和铜,所以①铁会与硫酸、硫酸铜转化成硫酸亚铁,所以滤液M中一定含有硫酸亚铁,可能含有硫酸和硫酸铜,故错误;②锌的金属活动性排在铜、铁、氢之前,所以在滤液M中放入一块刚打磨过的锌片,一定有置换反应发生,故正确;③滤渣中可能含有铁,所以向滤渣N中滴加稀硫酸,可能有气泡产生,故正确;④加入的硫酸不足以将氧化铜完全反应时,所以当滤液M中含有硫酸铜时,滤渣N中一定没有氧化铜,故错误。
故选:B -
第17题:
常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2.若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是()
- A、10:1
- B、1:10
- C、9:1
- D、1:9
正确答案:D -
第18题:
配制稀硫酸溶液先量取浓硫酸适量、然后将水加入浓硫酸中边加边搅拌。
正确答案:错误 -
第19题:
铁盐检查时,需加入过硫酸铵固体适量的目的在于()
- A、将高价态铁离子(Fe3+)还原为低价态铁离子(Fe2+)
- B、加速Fe3+和SCN的反应速度
- C、增加颜色深度
- D、将低价态铁离子(Fe2+)氧化为高价态铁离子(Fe3+),同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
正确答案:D -
第20题:
一定量的锌与100mL18.5mol•L-1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol•L-1。则生成的气体中SO2和H2的体积比为()。
- A、1:2
- B、2:1
- C、1:4
- D、4:1
正确答案:C -
第21题:
检查铁盐时,需加入过硫酸铵固体适量的目的在于()
- A、消除干扰
- B、加速Fe3+和SCN的反应速度
- C、增加颜色深度
- D、将低价态铁离子(FE2+.氧化为高价态铁离子(FE3+.,同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
- E、将高价态铁离子(FE3+.还原为低价态铁离子(FE2+.
正确答案:D -
第22题:
填空题用锌跟稀硫酸反应制取氢气时,若有1120mL(标准状况下)的氢气生成,则有____mol电子发生转移.正确答案: 0.1mol解析:
反应生成1.12L的氢气,即0.05mol氢气生成,每1mol氢气产生会转移电子2mol,因此,该反应共转移电子数0.1mol. -
第23题:
填空题氧化还原法测铁常用的有:()、()和()。 高锰酸钾法是用()为还原剂,将溶液中的三价铁还原为二价铁以后,再以()将稍过量的()氧化,用高锰酸钾溶液滴定()。用氯化亚锡还原三价铁的反应,必须在()溶液中进行,还原后的溶液应迅速(),否则在热盐酸溶液中生成的Fe2+易被()氧化,为了保证Fe3+完全变为Fe2+并阻止Fe2+的氧化,常常当溶液从黄色还原成无色后,再加入1~2滴()溶液,然后加入()氧化,此时生成甘汞白色丝状;如果还原时加入()量过多,则()(Hg2Cl2)进一步还原成()沉淀,它易被高锰酸钾氧化,使铁的结果()。正确答案: 高锰酸钾法,重铬酸钾法,碘量法,氯化亚锡,氯化汞,氯化亚锡,Fe2+,强盐酸热,冷却,空气,氯化亚锡,二氯化汞饱和溶液,氯化亚锡,氯化亚汞,金属汞,偏高解析: 暂无解析 -
第24题:
填空题将54.4g铁和氧化铁的混合粉末投入到适量的稀硫酸中,充分反应后收集到4.48L(标准状况下)氢气并测得溶液中既没有Fe3+也没有固体物质残留,则原混合粉末中铁和氧化铁的质量分别是____g和____g,反应中硫酸消耗掉____mol,反应后得到硫酸亚铁的物质的量是____mol.正确答案: 22.4,32,0.8,0.8解析:
由分析题意可知,最终剩余的铁和三价铁离子恰好完全反应.混合物中的铁的计算分为两部分,一部分是与稀硫酸反应生成氢气,另一部分是和三价铁离子(剩余部分的稀硫酸氧化铁全部转化为三价铁离子)完全反应,生成二价铁离子.
