已知碳元素的相对原子质量为12,水的相对分子质量为18,氢的相对原子质量为1,氧的相对原子质量为16,下列表述正确的是()A、Imol的碳原子质量是12gB、含6.02x1023个水分子的水的质量是9gC、6×1023个碳原子的质量为12gD、16×1023个氧原子的质量为6.02g
题目
已知碳元素的相对原子质量为12,水的相对分子质量为18,氢的相对原子质量为1,氧的相对原子质量为16,下列表述正确的是()
- A、Imol的碳原子质量是12g
- B、含6.02x1023个水分子的水的质量是9g
- C、6×1023个碳原子的质量为12g
- D、16×1023个氧原子的质量为6.02g
相似考题
参考答案和解析
更多“已知碳元素的相对原子质量为12,水的相对分子质量为18,氢的相对原子质量为1,氧的相对原子质量为16,下列表述正确的是()A、Imol的碳原子质量是12gB、含6.02x1023个水分子的水的质量是9gC、6×1023个碳原子的质量为12gD、16×1023个氧原子的质量为6.02g”相关问题
-
第1题:
计算下列换算因数: (1)根据Mg2P2O7的质量测定氧化镁的含量。 (2)根据Fe2O3的质量测定Fe的含量。 已知:MgO的相对分子质量为40.30;Mg2P2O7相对分子质量为222.55;Fe的相对原子质量为55.847,Fe2O3相对分子质量为159.69。
正确答案: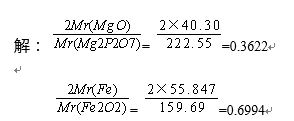
-
第2题:

二、考题解析
【教学过程】
(一)提出疑问,引入新课
【多媒体展示】原子氢原子、氧原子、碳原子、铝原子的质量(科学计数法,单位:kg)。
【教师提问】通过上节课的学习,我们知道原子是质量、体积都很小的微粒,那原子的质量我们要如何简便的表示出来呢?
(二)类比练习,学习新知
【学生活动】以千克为单位,用小数的形式写出导入环节展示的原子的质量。
【教师引导】生活中,我们用“千米”衡量北京到天津的距离,用“光年”衡量宇宙中星球间的距离。若以“千克”为单位表示原子的质量,就好比用“光年”衡量北京到天津的距离,也好比用“吨”来表示一个苹果的体重。
【教师讲解】国际上一般用相对原子质量来表示原子的质量。
【学生活动】自主阅读相对原子质量的定义,尝试用自己的语言表述对相对原子质量的理解。
【学生总结】以一种碳原子的质量的1/12作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。
【教师讲解】讲述科学家确定相对原子质量标准的研究过程,强调相对原子质量是为了计算简便而人为规定的。
【多媒体展示】张青莲教授为相对原子质量的测定做出的贡献。
【教师引导】原子的质量非常小,所以在化学中使用相对原子质量。而分子的质量与我们宏观的物质相比,质量仍然微乎其微,那么在化学中如何表示分子的质量呢?
【学生回答】通常用相对分子质量表示分子质量的大小。
【教师引导】分子是由什么构成的?以水分子微粒说明。
【学生回答】一个水分子是由一个氧原子和两个氢原子构成的。
【教师引导】如何由相对原子质量得出相对分子质量?
【学生总结】相对分子质量等于构成分子的各原子的相对原子质量的总和。
【教师讲解】H2O的相对分子质量=氧原子的相对原子质量+2×氢原子的相对原子质量
【学生活动】计算二氧化碳分子(CO2)的相对分子质量。
(三)加深理解,巩固练习
【思考1】相对原子质量和相对分子质量是否有单位?
【解析】没有单位。
【思考2】参考相对原子质量表,计算H2SO4的相对分子质量。
【解析】98。
(四)课堂小结,课后作业
小结:请学生用自己的语言概述对相对原子质量和相对分子质量的理解。
 答案:解析:
答案:解析:

-
第3题:
已知常见元素的相对原子质量为H为1;O为16;C为12;N为14。在下列几种常见的气体中,()的相对分子质量最大。
- A、N2
- B、C02
- C、H2
- D、02
正确答案:B -
第4题:
已知硫的相对原子质量为32,那么硫酸的相对分子质量为()
- A、81
- B、82
- C、98
- D、32
正确答案:C -
第5题:
氧的相对原子质量等于()。
- A、16g
- B、8g
- C、16
- D、1.993×10-22g
正确答案:C -
第6题:
以物质的()为基本单元时,其摩尔质量的数值等于相对原子质量。
- A、原子
- B、分子
- C、离子
- D、电子
正确答案:A -
第7题:
已知阴离子X2-有3个电子层,相对原子质量为32,则该离子的中子数是16,核内质子数是16。
正确答案:正确 -
第8题:
已知铝(Al)元素的相对原子质量为27,氧(O)元素的相对原子质量为16,氧化铝(A1203)的式量为()。
- A、27
- B、16
- C、102
- D、43
正确答案:C -
第9题:
原子质量单位(u),它的大小为一个碳原子质量的:()
- A、1/12
- B、1/4
- C、1/3
- D、1/2
正确答案:A -
第10题:
已知H的相对原子质量为1,O的相对原子质量为16,则H2O的相对分子质量为()。
- A、14
- B、16
- C、18
- D、20
正确答案:C -
第11题:
已知C的相对原子质量为12,O的相对原子质量为16,则CO2的相对分子质量为()。
- A、44
- B、50
- C、28
- D、30
正确答案:A -
第12题:
单选题某元素的+3价氧化物中,该元素和氧元素的质量比为13:6,则它的相对原子质量为( ).A26
B52
C78
D104
正确答案: B解析:
设氧化物为R2O3,由于该元素和氧元素的质量比为13:6,可以得出该元素的相对原子质量为52. -
第13题:
碳12原子的质量为1.993×10-26kg,一种铁原子的质量为9.288×10-26kg,计算该
铁原子的相对原子质量(保留小数点后一位)
铁的相对原子质量 一个铁原子的实际质量 9.288 x 10-26kg = = ≈55.9 一个碳 原子的质量 x 1/12 1.993 x 10-26kg x 1/12 -
第14题:
初中化学《相对原子质量》
一、考题回顾
二、考题解析
【教学过程】
环节一:导入新课
【提出问题】分子的质量和体积都很小,分子由原子构成,那么原子的质量大小如何?
【学生回答】原子的质量和体积也很小。
【教师总结】原子的质量很小,1个氢原子的质量约为1.67×10-27 kg,1个氧原子的质量约为2.657×10-26 kg。
可以看出,使用“kg”作为单位表示原子的质量,书写与使用并不方便,有没有其他较为方便的方法呢?
环节二:新课教学
【提出问题】原子中有质子、中子、电子等微粒,不同微粒的质量是否相同,观看下图,说明自己能够得出的结论?
【多媒体展示】表3-2 构成原子的粒子的质量
?【学生回答】从表格中可以看出:①质子与中子的质量大致相等;②电子的质量相对质子、中子的质量可以忽略不计。
【教师总结】从表格中可以看出,原子的质量主要集中在原子核上。因此氢原子的质量大致与一个质子的质量相等,一个氧原子的质量大致与8个质子与8个中子的质量之和相等。
【教师引导】在很久以前,表示质量的大小、长度的大小、温度、高度人们有很多不同的方法,不同地区的人使用的方法不同,不同国家的人使用的方法也不同。
【提出问题】比如有关温度的表示,不同的国家是如何表示的,国际上采用的是何种方式?
【学生回答】我国采用的是摄氏温标,美国和一些英语国家采用的是华氏温标,温度的国际单位是开尔文,水的冰点摄氏温度计为0℃,开氏温度计为273.15 K。
【教师总结】由此可知,要方便的计量一个数据,可以找一个统一的标准。那么计量原子的质量采用的标准是什么?采用怎样的标准能够更加方便的书写与使用?请阅读教材进行说明,国际上采用的标准是什么?
【学生回答】国际上一致同意采用相对质量,即以一种碳原子质量的1/12为标准,其他原子的质量与它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar)。
【多媒体展示】图3-14。
【教师讲解】根据图示,以12C原子质量的1/12为标准,记为1。12个氢原子质量与1个12C原子质量相等,由此可知氢元素的相对原子质量为1。
【提出问题】氧的相对原子质量是16,代表的意义是什么?
【学生回答】氧原子质量是碳12C原子质量的1/12的16倍。
【提出问题】该种碳原子的相对原子质量是多少?
【学生回答】该种碳原子的相对原子质量是12。
【多媒体展示】元素周期表中前20号元素的相对原子质量。
【教师讲解】由于原子的质量主要集中在原子核上,因此在使用的时候我们多采用相对原子质量的近似值。
【提出问题】通过相对原子质量,能否比较原子质量的大小?怎样比较?
【学生回答】能够比较原子质量的大小,相对原子质量大的原子质量也大。
环节三:巩固提高
【多媒体播放】资料:张青莲与相对原子质量的测定。
【教师引导】张青莲教授为相对原子质量的测定做出了巨大的贡献。
环节四:小结作业
小结:学生总结本节课重点知识,教师补充。
作业:思考某种原子的相对原子质量与原子核内的质子数、中子数有何关系?
【板书设计】略答案:解析: -
第15题:
已知碳元素的相对原子质量为12,下列表述错误的是()。
- A、1个阿伏加德罗数的碳原子的质量约为12g
- B、6.02×1023个碳原子的质量为12g
- C、所含的基本单元数和12g的碳元素含有的原子数相等时的某物质的量是1mol
- D、任何物质的质量为12g时,其所含的分子或原子数为1个阿伏加德罗数
正确答案:D -
第16题:
计算题:出钢量为150t,钢水中氧含量700ppm,计算钢水全脱氧需要加多少铝?(小数点后保留一位有效数字,Al的相对原子质量是27,氧的相对原子质量是16)
正确答案: (1)反应式是2Al+3[O]=(Al2O3)
(2)钢水含养0.07%(700ppm),150t中总氧含量:150×1000×0.07%=105(Kg)
(3)计算铝加入量,设铝的加入量为x:
2Al+3[O]=(Al2O3)
(2×27)/x=(3×16)/105
x=(2×27×105)/(3×16)
x=118.1(Kg)
钢水全脱氧需要加入铝118.1Kg -
第17题:
假设可作确定相对原子质量标准的碳原子的质量为b克,一个X原子的质量为m克,则X的相对原子质量为()
- A、m∕12b
- B、m∕b
- C、12b∕m
- D、12m∕b
正确答案:D -
第18题:
碳的相对原子质量是()
- A、12g
- B、12
- C、1.66×10-27Kg
- D、1.66×10-27
正确答案:B -
第19题:
下列关于相对原子质量的叙述,正确的是()
- A、相对原子质量就是用原子质量单位表示原子的质量
- B、相对原子质量是一个没有单位的比值
- C、相对原子质量就是原子的实际质量
- D、计算相对原子质量的基准是碳12原子质量的1/12
正确答案:B,D -
第20题:
碳的相对原子质量是()
- A、12g
- B、1、2g
- C、1/12g
- D、1、993×10-26kg
正确答案:C -
第21题:
张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于11549In的说法中,错误的是()
- A、11549In原子核外有49个电子
- B、11549In原子核内有49个中子
- C、11549In原子核内质子数和中子数之和等于其质量数为115
- D、sup>11549In是In元素的一种核素
正确答案:B -
第22题:
相对原子质量只表示不同原子的相对质量,()单位。
- A、以千克为
- B、以摩尔为
- C、没有
- D、以克为
正确答案:C -
第23题:
已知C的相对原子质量为12,O的相对原子质量为16,则CO的相对分子质量为()。
- A、28
- B、30
- C、44
- D、50
正确答案:A
